题目内容
【题目】有一包固体粉末,可能由BaSO4、CuSO4、Na2CO3、BaCl2、NaCl中的一种或几种组成,其实验小组对其成分进行了以下探究活动
(1)【思考与交流】上述物质中不溶于水的是 , 溶于水其水溶液呈蓝色的是(均填化学式).
(2)【活动与探究】取上述固体,加入足量水溶解,形成无色透明的溶液,由于取用固体较多,在溶解过程中要用到的玻璃仪器有和 .
(3)再向上述溶液中加入盐酸,产生大量的气泡.说明该固体中一定含有(填化学式),该反应的化学方程式为 .
(4)经过以上探究,不能确定的物质是(填化学式).
(5)【探索与拓展】
为了进一步确定原固体粉末的组成,实验小组取22克该固体粉末,溶于110克水配制成不饱和溶液,再向该溶液中缓慢加入100克一定质量分数的CaCl2溶液,产生沉淀的质量与所加CaCl2溶液的质量关系如图所示,试计算: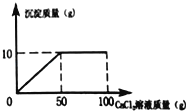
①恰好完全反应时生成沉淀的质量是多少?.
②22克样品中Na2CO3的质量是多少克?(需写出计算过程)
③反应后所得溶液中CaCl2的溶质质量分数是多少?(需写出计算过程)
【答案】
(1)BaSO4;CuSO4
(2)烧杯;玻璃棒
(3)Na2CO3;Na2CO3+2HCl═2NaCl+H2O+CO2↑
(4)NaCl
(5)
①由图示可知,恰好完全反应时生成沉淀的质量是10g.
②设样品中Na2CO3的质量为x,参加反应的氯化钙的质量为y,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100
y x 10g
![]() x=10.6g,
x=10.6g,
③ ![]() y=11.1g,
y=11.1g,
由图示可知,恰好完全反应后剩余的溶液中还氯化钙的质量也为11.1g.
反应后所得溶液中CaCl2的溶质质量分数是 ![]() ×100%=5%.
×100%=5%.
【解析】(1)BaSO4、CuSO4、Na2CO3、BaCl2、NaCl中BaSO4不溶于水,硫酸铜溶于水其水溶液呈蓝色.(2)取上述固体,加入足量水溶解,形成无色透明的溶液,则一定不含硫酸钡、CuSO4 , Na2CO3、BaCl2在溶液中反应生成碳酸钡白色沉淀,则Na2CO3、BaCl2不能共存.在溶解过程中要用到的玻璃仪器有烧杯和玻璃棒.(3)再向上述溶液中加入盐酸,产生大量的气泡,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳气体,则说明该固体中一定含有Na2CO3 , 一定不含氯化钡;反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.(4)氯化钠与上述物质均不反应,经过以上探究,不能确定的物质是氯化钠.(5)①由图示可知,恰好完全反应时生成沉淀的质量是10g.
所以答案是:(1)BaSO4;CuSO4;(2)烧杯;玻璃棒;(3)Na2CO3 , Na2CO3+2HCl═2NaCl+H2O+CO2↑;(4)NaCl;(5)①10g;②22克样品中Na2CO3的质量是10.6g;③反应后所得溶液中CaCl2的溶质质量分数是5%.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号,以及对根据化学反应方程式的计算的理解,了解各物质间质量比=系数×相对分子质量之比.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案