题目内容
石灰石是我省的主要矿产之一.学校研究性学小组为了测定当地矿山石灰石中碳酸钙的质量分数.取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2 的质量/g | 1.76 | 3.52 | 4.4 | m |
(2)试计算这种石灰石中碳酸钙的质量分数.
(3)上表中m值是______.
【答案】分析:(1)观察并对比表格中的数据可知:第2次实验中加入的样品和生成二氧化碳的质量均为第一次实验的两倍,同时可以判断5g样品能够产生1.76g二氧化碳,而第3次加入样品比第2次加入的样品多5g,而生成的二氧化碳的质量只产生了4.4g-3.52g=0.88g,说明此时盐酸已完全反应,故3、4次实验中碳酸钙有剩余;
(2)由(1)中的分析可以知道,实验1和实验2中样品中碳酸钙均完全反应,所以碳酸钙的质量分数可根据第1次或第2次实验中二氧化碳的质量求出.根据化学方程式得出各物质之间的质量比,列出比例式,即可求出参加反应的CaCO3的质量,然后再根据质量分数公式进行计算即可;
(3)通过对表格中数据结合(1)的分析可以判定出m的值.
解答:解:(1)由表格中的数据可知,第3次反应中的碳酸钙已完全反应且盐酸有剩余,故第3、4次反应中的碳酸钙的质量有剩余.
(2)设第1次实验中样品中的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.76g

解之得:x=4g,
石灰石中碳酸钙的质量分数为: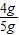 ×100%=80%.
×100%=80%.
答:石灰石中碳酸钙的质量分数为80%.
(3)因为第3次反应已是完全反应,不再有气体产生,故第四次反应生成的气体质量的第三次的一样多,即m的值为4.4.
故答案为:
(1)3、4两次;
(2)80%;
(3)4.4.
点评:本题主要考查学生对完全反应的概念的认识,以及运用化学方程式和质量分数公式进行计算的能力.
(2)由(1)中的分析可以知道,实验1和实验2中样品中碳酸钙均完全反应,所以碳酸钙的质量分数可根据第1次或第2次实验中二氧化碳的质量求出.根据化学方程式得出各物质之间的质量比,列出比例式,即可求出参加反应的CaCO3的质量,然后再根据质量分数公式进行计算即可;
(3)通过对表格中数据结合(1)的分析可以判定出m的值.
解答:解:(1)由表格中的数据可知,第3次反应中的碳酸钙已完全反应且盐酸有剩余,故第3、4次反应中的碳酸钙的质量有剩余.
(2)设第1次实验中样品中的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.76g

解之得:x=4g,
石灰石中碳酸钙的质量分数为:
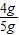 ×100%=80%.
×100%=80%.答:石灰石中碳酸钙的质量分数为80%.
(3)因为第3次反应已是完全反应,不再有气体产生,故第四次反应生成的气体质量的第三次的一样多,即m的值为4.4.
故答案为:
(1)3、4两次;
(2)80%;
(3)4.4.
点评:本题主要考查学生对完全反应的概念的认识,以及运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目


