题目内容
用“>”或“=”或“<”符号进行填空:(1)V1mL水与V2mL酒精混合成V3mL溶液,则V1+V2________V3。
(2)t℃时某物质的溶解度为Sg,其饱和溶液中溶质的质量分数为A%,则S________A。
(3)把40g溶质的质量分数为20%的食盐水倒出一半放在另一烧杯中,剩下的食盐水中溶质的质量分数________20%%。
解析:
| (1)>
(2)> (3) =
|
提示:
| 水和酒精混合后得到的溶液的体积小于水和酒精各自体积之和,说明分子之间是有间隔的;溶液是均一、稳定的,倒出一部分溶液后,剩下的溶液的性质没有发生任何变化。
|

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
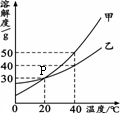
全程金卷系列答案甲、乙两种固体物质的溶解度曲线如右图所示。
(1)图中P点的含义是__ ___。
(2)40℃时,饱和溶液中溶质的质量分数:甲___ __乙(填“>”、“=”或“<”)。20℃时,将60 g乙物质放入100 g水中,升温至40℃,溶液中溶解的溶质与溶剂的质量比为___ (用最简整数比表示)。
(3)20℃时,进行了如下图所示的实验:
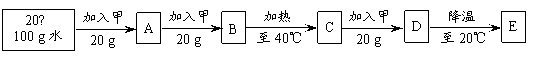 |
上述实验过程中所得的溶液,属于不饱和溶液的是_____(填序号,下同),_____溶液与B溶液中溶质的质量分数相同。
下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃)。
| 溶液中溶质的 质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的 密度/g·mL-1 | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/g·mL-1 | 0.98 | 0.95 | 0.94 | 0.91 | 0 |
请你仔细分析后回答下列问题:
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,它们的密度变化情况:对于硫酸溶液:  ;对于氨水: 。
;对于氨水: 。
(2)向100 g 24%的氨水中加入100 g水,摇匀,溶液的体积为 mL。
(3)向质量分数为24%的硫酸中加入等体积的水,所得溶液中溶质质量分数
12%;向质量分数为24%的氨水中加入等体积的水,所得溶液中溶质质量
分数 12%(用“>”“<”或“=”填空),根据以上计算或推理的结果,总结出的规律是 。

 .90
.90