题目内容
【题目】天然水需要经过自来水厂的层层净化处理后变成城市的生活用水。以下是某自来水厂净水过程如图所示:
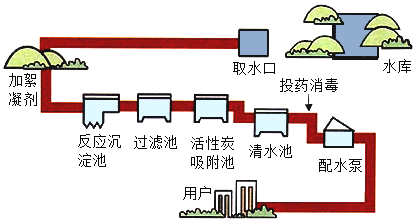
(1)工厂的净水过程中,常用的絮凝剂是__________(只需写一种物质的名称),其作用是__________。
(2)过滤池所起的作用是____________________。
A.杀死水中的细菌 B.减少水中氯气
C.除去不溶性杂质 D.分解有毒物质
(3)投药消毒的过程中自来水厂常用的消毒剂除氯气外,还可用一氯胺(NH2Cl)、二氧化氯等物质。①二氧化氯的化学式为__________;
②NH2Cl 中氮、氢、氯三种元素的质量比是__________(结果用最简整数比表示)。
(4)生产的自来水通常有一定的硬度,生活中将自来水软化的常用方法是_________________。常用来区分软化和硬水的方法是____________________。
【答案】明矾 雨水作用,吸附杂质使之沉降 C ClO2 28:4:71 煮沸 取等量水加于试管中,加入等量肥皂水,震荡,若出现较多泡沫,较少浮渣则为软水若出现较多浮渣则为硬水
【解析】
(1)由于明矾溶于水生成的胶状物具有吸附性,取水后加入絮凝剂的作用是吸附悬浮杂质,加速沉降;
(2)过滤池的作用是除去水中难溶性的杂质;
(3)①由氧化物的读法以及化学式的写法可知,二氧化氯的化学式为ClO2;
②NH2C1中氮、氢、氯三种元素的质量比是14:(1×2):35.5=28:4:71;
(4)生活中将自来水软化的常用方法是煮沸;检验硬水和软水的简单办法是加入肥皂水,硬水和软水的区别在于所含钙镁离子的多少,钙镁离子可以和肥皂水产生浮渣,所以可用肥皂水来区分硬水和软水。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】将一定质量的a、b、c、d四中物质放入一密闭容器中,.在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法正确的是
物质 | a | b | c | d |
反应前质量/g | 6.40 | 3.20 | 4.00 | 0.50 |
反应后质量/g | 待测 | 2.56 | 7.20 | 0.50 |
A. a和b是反应物,d是催化剂
B. 反应后a物质的质量为4.64g
C. 物质中元素的种类,和a、b两种物质中元素的种类不同
D. 若a物质与b物质的相对分子质量之比为2:1 ,则反应汇总a和b的化学计量数之比一定是2:1