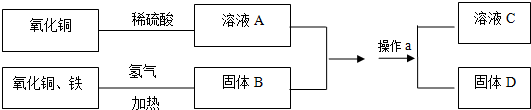
题目内容
 (2013?黄浦区二模)根据下表实验,回答相关问题
(2013?黄浦区二模)根据下表实验,回答相关问题| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 在盛有100g水的烧杯中,加入25g氯化钾,搅拌,恢复到20℃. | 全部溶解 |
| Ⅱ | 再加Xg氯化钾,搅拌,恢复到20℃,恰好饱和. | 全部溶解 |
| Ⅲ | 再加6g氯化钾,搅拌,恢复到20℃ | 固体不溶 |
| Ⅳ | 加热 | 全部溶解 |
| Ⅴ | 冷却至20℃ | 有固体析出 有固体析出 |
钾
钾
肥.②实验步骤Ⅱ中加入Xg氯化钾,X=
9
9
g.③实验步骤Ⅲ中所得溶液是
饱和
饱和
(填“饱和”或“不饱和”)溶液.④实验步骤Ⅳ至少加热到
40
40
℃,固体全部溶解.⑤冷却至20℃,烧杯中的现象是
有固体析出
有固体析出
.⑥有五瓶氯化钾溶液,与上述实验步骤Ⅰ-Ⅴ形成的溶液溶质质量分数分别相等,现各取10g于5个小烧杯中,分别滴入足量的等质量等浓度的硝酸银溶液,写出反应的化学方程式
AgNO3+KCl═AgCl↓+KNO3
AgNO3+KCl═AgCl↓+KNO3
,其中有3
3
个小烧杯中产生的沉淀质量相等.⑦有两瓶无色透明溶液,分别是氯化钾溶液和碳酸钾溶液,请用一种盐溶液鉴别这两瓶试剂.
| 实验步骤 | 实验现象与结论 |
| 取样,加入 BaCl2或Ba(NO3)2 BaCl2或Ba(NO3)2 |
产生白色沉淀 产生白色沉淀 ,是碳酸钾溶液 |
分析:根据20℃氯化钾的溶解度考虑①根据钾肥的判断方法考虑;②根据20℃氯化钾的溶解度考虑;③根据有固体不溶考虑;④根据一共加入的溶质质量,再对应不同温度时的溶解度考虑;⑤根据降温后20℃氯化钾的溶解度减小了考虑;⑥根据方程式的写法和溶液中含氯化钾质量的多少考虑;⑦根据盐与盐溶液产生沉淀考虑.
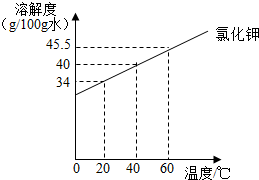
解答:解:20℃氯化钾的溶解度是34g,到了第Ⅴ步一共加入氯化钾质量为:25g+9g+6g=40g,所以降温后溶解度减小,会析出固体;
①化学式中只含有氮、磷、钾三种营养元素中的钾元素的属于钾肥,所以氯化钾属于钾肥;
②20℃氯化钾的溶解度是34g,已经加了25g,所以还需要加入34g-25g=9g;
③再加6g氯化钾,搅拌,恢复到20℃有固体不溶解,说明已经达到饱和;
④前三步一共加入氯化钾质量为:25g+9g+6g=40g,由图可知氯化钾的溶解度在40℃时溶解度是40g,所以加热到40℃固体全部溶解;
⑤降温后溶解度减小所以会析出晶体,即有固体析出;
⑥滴入硝酸银后反应物是氯化钾和硝酸银,生成物是氯化银和硝酸钾,氯化银后面标上沉淀符号,在溶液中含有氯化钾质量相同的生成沉淀质量就相同,在第Ⅱ、Ⅲ、Ⅴ三步中氯化钾质量都是34g,所以这三个烧杯中生成沉淀相同;
⑦由于碳酸根离子与钡离子或钙离子生成白色沉淀,所以可以用氯化钡、硝酸钡、氯化钙、硝酸钙等物质,结论是有白色沉淀生成的是碳酸钾,没有白色沉淀生成的是氯化钾.
故答案为:有固体析出;①钾;②9;③饱和;④40;⑤有固体析出;⑥AgNO3+KCl═AgCl↓+KNO3;3;
⑦
①化学式中只含有氮、磷、钾三种营养元素中的钾元素的属于钾肥,所以氯化钾属于钾肥;
②20℃氯化钾的溶解度是34g,已经加了25g,所以还需要加入34g-25g=9g;
③再加6g氯化钾,搅拌,恢复到20℃有固体不溶解,说明已经达到饱和;
④前三步一共加入氯化钾质量为:25g+9g+6g=40g,由图可知氯化钾的溶解度在40℃时溶解度是40g,所以加热到40℃固体全部溶解;
⑤降温后溶解度减小所以会析出晶体,即有固体析出;
⑥滴入硝酸银后反应物是氯化钾和硝酸银,生成物是氯化银和硝酸钾,氯化银后面标上沉淀符号,在溶液中含有氯化钾质量相同的生成沉淀质量就相同,在第Ⅱ、Ⅲ、Ⅴ三步中氯化钾质量都是34g,所以这三个烧杯中生成沉淀相同;
⑦由于碳酸根离子与钡离子或钙离子生成白色沉淀,所以可以用氯化钡、硝酸钡、氯化钙、硝酸钙等物质,结论是有白色沉淀生成的是碳酸钾,没有白色沉淀生成的是氯化钾.
故答案为:有固体析出;①钾;②9;③饱和;④40;⑤有固体析出;⑥AgNO3+KCl═AgCl↓+KNO3;3;
⑦
| 实验步骤 | 实验现象与结论 |
| 取样,加入 BaCl2或Ba(NO3)2 | 产生白色沉淀,是碳酸钾溶液 |
点评:解答本题关键是要知道化学肥料的识别方法,掌握根据溶解度判断溶液是否饱和的方法,熟悉方程式的书写注意事项.

练习册系列答案
相关题目