题目内容
酸、碱、盐均为重要的化合物.
(1)工业上电解饱和食盐水可制取烧碱、H2、Cl2,请写出该反应的化学方程式 .
(2)请写出一个既能检验烧碱变质、又能除去杂质的有关反应的化学方程式 .
(3)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条 .
(4)配制一定质量分数的氢氧化钠溶液,有关操作如图所示:
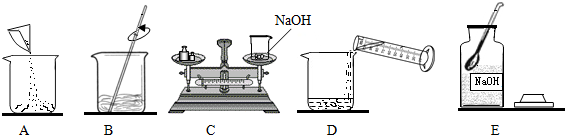
以上实验的正确操作顺序为 ;(用字母代号表示);C操作中出现的错误 ;若C中砝码的质量为15g,游码的读数为3.5g,则氢氧化钠和烧杯的实际总质量为 g
(5)用pH试纸测定所配制溶液的酸碱度,操作方法为 .
(6)现有一样品,经分析含氢氧化钾、碳酸钾和水三种物质,向该样品中加入溶质质量分数为9.8%的稀硫酸100g,恰好完全反应得到中性溶液.试计算:蒸干该溶液可得到的固体的质量是多少?
(1)工业上电解饱和食盐水可制取烧碱、H2、Cl2,请写出该反应的化学方程式
(2)请写出一个既能检验烧碱变质、又能除去杂质的有关反应的化学方程式
(3)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条
(4)配制一定质量分数的氢氧化钠溶液,有关操作如图所示:

以上实验的正确操作顺序为
(5)用pH试纸测定所配制溶液的酸碱度,操作方法为
(6)现有一样品,经分析含氢氧化钾、碳酸钾和水三种物质,向该样品中加入溶质质量分数为9.8%的稀硫酸100g,恰好完全反应得到中性溶液.试计算:蒸干该溶液可得到的固体的质量是多少?
分析:(1)根据反应物、生成物和反应条件,遵守质量守恒定律,依据客观事实书写方程式;
(2)要想检验并除去碳酸钠,所选试剂只能和碳酸钠反应,不能和氢氧化钠反应;
(3)根据酸和碱的组成特点及性质分析解答;
(4)根据溶液配制的步骤、注意事项分析解答;物码倒置时,实际称量物的质量=砝码的质量-游码的质量;
(5)根据用pH试纸测定溶液pH值的方法回答;
(6)氢氧化钾、碳酸钾与硫酸反应都生成硫酸钾,根据质量守恒定硫酸钾中的硫酸根都来自硫酸,根据硫酸根质量守恒及关系式来进行解答.
(2)要想检验并除去碳酸钠,所选试剂只能和碳酸钠反应,不能和氢氧化钠反应;
(3)根据酸和碱的组成特点及性质分析解答;
(4)根据溶液配制的步骤、注意事项分析解答;物码倒置时,实际称量物的质量=砝码的质量-游码的质量;
(5)根据用pH试纸测定溶液pH值的方法回答;
(6)氢氧化钾、碳酸钾与硫酸反应都生成硫酸钾,根据质量守恒定硫酸钾中的硫酸根都来自硫酸,根据硫酸根质量守恒及关系式来进行解答.
解答:解:(1)电解饱和食盐水生成氢气、氯气(Cl2)和烧碱:2NaCl+2H2O
2NaOH+Cl2↑+H2↑;
故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑;
(2)既能证明它是否发生变质,又能除去该杂质的药品可选用氢氧化钙溶液,氢氧化钡溶液,不能选择酸溶液,因为酸溶液和氢氧化钠也会发生反应,故有关反应的化学方程式为 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
故答案为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH(合理均可);
(3)酸中一定含有氢元素,碱中一定含有氢氧根,故二者在组成上的相同点是都含有氢元素;此外,酸和碱还都能与部分盐发生反应;
故答案为:酸和碱都含有氢元素(合理均可);
(4)配制溶液的一般步骤是:计算、称量、溶解、装瓶;故实验的正确顺序是:取药品称量,倒入烧杯,量取水,倒入烧杯,搅拌溶解;C操作中出现的错误是将物码倒置,用天平称量时,称量物应放在左盘,砝码放在右盘;氢氧化钠和烧杯的实际总质量为15g-3.5g=11.5g;
故答案为:ECADB;物码倒置;11.5g;
(5)用pH试纸测定所配制溶液的酸碱度,测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
故答案为:
用干燥的玻璃棒蘸取(或胶头滴管吸取)少待测溶液,滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)反应后溶液呈中性,说明硫酸中的硫酸根恰好全部转化为硫酸钾;
根据硫酸根守恒及二者之间的关系式可知,H2SO4~K2SO4可知:
最后得到的固体硫酸钾的质量为:100g×9.8%×
=17.4g;
答:蒸干该溶液可得到硫酸钾的质量是17.4克.
| ||
故答案为:2NaCl+2H2O
| ||
(2)既能证明它是否发生变质,又能除去该杂质的药品可选用氢氧化钙溶液,氢氧化钡溶液,不能选择酸溶液,因为酸溶液和氢氧化钠也会发生反应,故有关反应的化学方程式为 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
故答案为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH(合理均可);
(3)酸中一定含有氢元素,碱中一定含有氢氧根,故二者在组成上的相同点是都含有氢元素;此外,酸和碱还都能与部分盐发生反应;
故答案为:酸和碱都含有氢元素(合理均可);
(4)配制溶液的一般步骤是:计算、称量、溶解、装瓶;故实验的正确顺序是:取药品称量,倒入烧杯,量取水,倒入烧杯,搅拌溶解;C操作中出现的错误是将物码倒置,用天平称量时,称量物应放在左盘,砝码放在右盘;氢氧化钠和烧杯的实际总质量为15g-3.5g=11.5g;
故答案为:ECADB;物码倒置;11.5g;
(5)用pH试纸测定所配制溶液的酸碱度,测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
故答案为:
用干燥的玻璃棒蘸取(或胶头滴管吸取)少待测溶液,滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)反应后溶液呈中性,说明硫酸中的硫酸根恰好全部转化为硫酸钾;
根据硫酸根守恒及二者之间的关系式可知,H2SO4~K2SO4可知:
最后得到的固体硫酸钾的质量为:100g×9.8%×
| 174 |
| 98 |
答:蒸干该溶液可得到硫酸钾的质量是17.4克.
点评:本题考查知识综合,掌握酸和碱的组成、性质、溶液的配制等知识是解答此题的基础和关键,要根据所求内容细心逐一分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目