题目内容
根据要求回答下列问题:
(1)实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究.请根据要求回答问题:
①打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生.据此可知,浓硝酸具有______(填一条物理性质).
②将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体(NO2)产生.据此现象可推知浓硝酸具有______(填一条化学性质).
③通过上述实验可知,实验室应如何保存浓硝酸?______.
(2)如图是A、B、C三种固体物质在水中的溶解度曲线,据图回答:
①t1℃时ABC的溶解度由大到小的顺序是______.
②当A物质中混有少量B物质时,通常可采用______的方法提纯A.
③将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃后(升温过程中溶剂量不变),三种溶液中溶质的质量分数由大到小的顺序是______(填序号)
(3)有一包白色粉末由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成.为确定其组成,进行如下实验,请根据实验现象填空
①取少量白色粉末,向其中加足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液.则白色粉末中一定不含有______.
②取实验①滤出的白色沉淀,向其中加入足量的稀盐酸,沉淀全部溶解并产生无色气体.原白色粉末中一定含有______.
解:(1)①当打开装有浓硝酸的试剂瓶时,在瓶口有白雾产生,是因为挥发出的硝酸与空气中的水蒸气结合而形成的,所以浓硝酸具有易挥发的物理性质.
②浓硝酸在加热或光照时因为产生了红棕色的气体,生成了新的物质,所以发生的是化学变化,体现的是浓硝酸的不稳定性.从而得出浓硝酸易分解的化学性质.
③通过上述实验的叙述得出的浓硝酸的性质是易挥发见光易分解,所以保存浓硝酸应避光并密封保存.
(2)①从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时它们的溶解度大小顺序是B>C>A;
②如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于A的溶解度随温度变化比较大,所以提纯A的方法是冷却热饱和溶液(或降温结晶);
③饱和溶液的质量分数=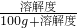 ×100%,所以饱和溶液的质量分数主要取决于溶解度的大小;t1℃时A、B、C三种物质溶解度大小是:B>C>A,所以饱和溶液的质量分数也是B>C>A,升温后A和B的溶解度增大,由饱和变为不饱和,溶质质量分数不变,所以升温后的溶质质量分数还是B>A,C物质溶解度减小,会析出晶体,溶质质量分数在计算时要按照t2℃时溶解度计算,由于t2℃时C的溶解度大于A物质在t1℃时的溶解度,小于B物质在t1℃时的溶解度,所以升温后的溶质质量分数大小是:B>C>A;
×100%,所以饱和溶液的质量分数主要取决于溶解度的大小;t1℃时A、B、C三种物质溶解度大小是:B>C>A,所以饱和溶液的质量分数也是B>C>A,升温后A和B的溶解度增大,由饱和变为不饱和,溶质质量分数不变,所以升温后的溶质质量分数还是B>A,C物质溶解度减小,会析出晶体,溶质质量分数在计算时要按照t2℃时溶解度计算,由于t2℃时C的溶解度大于A物质在t1℃时的溶解度,小于B物质在t1℃时的溶解度,所以升温后的溶质质量分数大小是:B>C>A;
(3)①把白色粉末溶解后得无色溶液,可知一定没有硫酸铜,因为硫酸铜溶于水会使溶液变蓝;
②实验①中的白色固体可能是碳酸钙,也可能是硫酸钠与氯化钡反应后生成的硫酸钡沉淀,但是硫酸钡不溶于水而且不溶于酸,而题目中的白色沉淀全部溶于稀盐酸中,说明这种白色沉淀是碳酸钙;
故答案为:(1)①挥发性; ②见光或受热易分解; ③密封、避光、阴凉处保存;(2)①B>C>A;②冷却热饱和溶液(或降温结晶);③B>C>A;(3)①CuSO4;②CaCO3.
分析:(1)在瓶口有白雾产生说明浓硝酸具有强挥发性.由浓硝酸在见光时能分解生成二氧化氮红色气体,体现了硝酸在加热或光照时不稳定,因为浓硝酸易挥发和见光易分解的性质所以我们得出硝酸的保存方法.(2)①根据某一温度时物质溶解度的比较方法考虑;②根据固体物质从溶液中结晶析出的方法考虑;③根据饱和溶液的质量分数的计算方法考虑;(3)硫酸铜为白色固体,溶于水后其水溶液呈蓝色,氯化钡和硫酸钠可以反应生成不溶于水且不溶于酸的白色沉淀;在书写可能的组合时,尽可能的根据题意把每一组合写出,要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
点评:由题目中所给出的信息可以得出我们所需要的知识,所以认真审题是完成好题目的关键.本题还考查了盐的性质,要求学生熟练的掌握盐的水溶性及两种盐之间的反应.
②浓硝酸在加热或光照时因为产生了红棕色的气体,生成了新的物质,所以发生的是化学变化,体现的是浓硝酸的不稳定性.从而得出浓硝酸易分解的化学性质.
③通过上述实验的叙述得出的浓硝酸的性质是易挥发见光易分解,所以保存浓硝酸应避光并密封保存.
(2)①从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时它们的溶解度大小顺序是B>C>A;
②如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于A的溶解度随温度变化比较大,所以提纯A的方法是冷却热饱和溶液(或降温结晶);
③饱和溶液的质量分数=
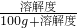 ×100%,所以饱和溶液的质量分数主要取决于溶解度的大小;t1℃时A、B、C三种物质溶解度大小是:B>C>A,所以饱和溶液的质量分数也是B>C>A,升温后A和B的溶解度增大,由饱和变为不饱和,溶质质量分数不变,所以升温后的溶质质量分数还是B>A,C物质溶解度减小,会析出晶体,溶质质量分数在计算时要按照t2℃时溶解度计算,由于t2℃时C的溶解度大于A物质在t1℃时的溶解度,小于B物质在t1℃时的溶解度,所以升温后的溶质质量分数大小是:B>C>A;
×100%,所以饱和溶液的质量分数主要取决于溶解度的大小;t1℃时A、B、C三种物质溶解度大小是:B>C>A,所以饱和溶液的质量分数也是B>C>A,升温后A和B的溶解度增大,由饱和变为不饱和,溶质质量分数不变,所以升温后的溶质质量分数还是B>A,C物质溶解度减小,会析出晶体,溶质质量分数在计算时要按照t2℃时溶解度计算,由于t2℃时C的溶解度大于A物质在t1℃时的溶解度,小于B物质在t1℃时的溶解度,所以升温后的溶质质量分数大小是:B>C>A;(3)①把白色粉末溶解后得无色溶液,可知一定没有硫酸铜,因为硫酸铜溶于水会使溶液变蓝;
②实验①中的白色固体可能是碳酸钙,也可能是硫酸钠与氯化钡反应后生成的硫酸钡沉淀,但是硫酸钡不溶于水而且不溶于酸,而题目中的白色沉淀全部溶于稀盐酸中,说明这种白色沉淀是碳酸钙;
故答案为:(1)①挥发性; ②见光或受热易分解; ③密封、避光、阴凉处保存;(2)①B>C>A;②冷却热饱和溶液(或降温结晶);③B>C>A;(3)①CuSO4;②CaCO3.
分析:(1)在瓶口有白雾产生说明浓硝酸具有强挥发性.由浓硝酸在见光时能分解生成二氧化氮红色气体,体现了硝酸在加热或光照时不稳定,因为浓硝酸易挥发和见光易分解的性质所以我们得出硝酸的保存方法.(2)①根据某一温度时物质溶解度的比较方法考虑;②根据固体物质从溶液中结晶析出的方法考虑;③根据饱和溶液的质量分数的计算方法考虑;(3)硫酸铜为白色固体,溶于水后其水溶液呈蓝色,氯化钡和硫酸钠可以反应生成不溶于水且不溶于酸的白色沉淀;在书写可能的组合时,尽可能的根据题意把每一组合写出,要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
点评:由题目中所给出的信息可以得出我们所需要的知识,所以认真审题是完成好题目的关键.本题还考查了盐的性质,要求学生熟练的掌握盐的水溶性及两种盐之间的反应.

练习册系列答案
相关题目

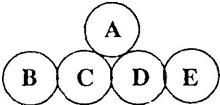 A、B、C、D、E分别是氧化铜、稀盐酸、硝酸银溶液、氯化钠溶液、铁中的一种,用两圆相切表示两种物质可能发生反应.请根据要求回答下列问题:
A、B、C、D、E分别是氧化铜、稀盐酸、硝酸银溶液、氯化钠溶液、铁中的一种,用两圆相切表示两种物质可能发生反应.请根据要求回答下列问题: 如图,是小东在实验室探究CO2化学性质的装置图,请根据要求回答下列问题:
如图,是小东在实验室探究CO2化学性质的装置图,请根据要求回答下列问题: