题目内容
某化学小组成功完成了下图所示实验(装置气密性良好),验证了二氧化碳的组成。
探究过程如下:

1. 称量装有干燥块状木炭的试管D,质量为50.7g,装有碱石灰的装置C质量为112.3g,连接A、B、D装置;
2. 从长颈漏斗加入足量3%的过氧化氢溶液,连接C装置,点燃酒精灯;
3.待D中发生反应,熄灭酒精灯,冷却;
4. 称量试管D及剩余固体的质量为50.1g,装置C的质量为114.5g
已知:碱石灰的成分是氧化钙和氢氧化钠,木炭中的杂质不参与反应,B、C中所装药品足量,能完全吸收相关物质。请回答下列问题:
装置A反应的化学方程式为_____________________,该反应属于_________反应
酒精灯加热的作用是_____________________
为减小误差,步骤Ⅲ冷却过程中需要注意的问题是_______________________
根据实验数据计算参加反应的氧气的质量为(列式并计算)_____________,从而计算出二氧化碳中碳、氧元素的质量比。
(1)2H2O2 2H2O+O2↑ 分解(2)点燃木炭
2H2O+O2↑ 分解(2)点燃木炭
(3)继续能氧气(4)(114.5g-112.3g)-(50.7g-50.1g)=1.6g
【解析】(1)装置A中的物质为过氧化氢与二氧化锰,作用是生成氧气。反应为: 2H2O2 2H2O+O2↑,反应的基本类型为分解反应。
2H2O+O2↑,反应的基本类型为分解反应。
(2)D的作用是让氧气与木炭反应,所以酒精灯的作用是点燃木炭。
(3)如果在冷却过程中或冷却前停止通氧气,则会出现由于温度降低造成D中气压降低,从而将空气吸入C中。空气中含有的水蒸气、二氧化碳气体与碱石灰反应,会使C中的质量变化值偏大,进一步影响实验结果。
(4)根据质量守恒定律,参与反应的氧气的质量应为生成的二氧化碳的质量[C中增重,为(114.5g-112.3g)]减去参与反应的木炭的质量[D中减少的质量,为(50.7g-50.1g)]。
点评:本题为实验综合题目。结合测定二氧化碳的组成,考查了氧气的制取、木炭与氧气的反应、质量守恒定律等知识点。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案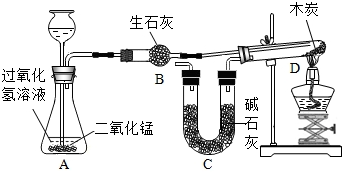



 ,装有碱石灰的装置C质量为112.3g,连接A、B、D装置;
,装有碱石灰的装置C质量为112.3g,连接A、B、D装置; 待D中发生反应,熄灭酒精灯,冷却;
待D中发生反应,熄灭酒精灯,冷却;