题目内容
【题目】有一包固体,可能含有碳酸钙、氧化铜、氧化铁、炭粉(炭粉的化学性质和一氧化碳相似)中的一种或几种.现做如图实验:
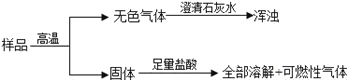
则原固体一定有________,一定没有________,可能有________.
【答案】氧化铁、炭粉 氧化铜 碳酸钙
【解析】
①已知取少量试样,隔绝空气加热至高温,生成一种能使澄清石灰水变混浊的气体,即表明在高温条件下有二氧化碳气体的产生.原固体中可能是碳酸钙分解生成氧化钙和二氧化碳.也可是木炭粉与氧化铜反应生成铜和二氧化碳气体或木炭与氧化铁反应生成铁和二氧化碳气体的.因此这几种固体都是可能存在的.反应后剩余固体可能是氧化钙或铜或铁等.②又知再冷却后的固体残留物上加足量稀盐酸,固体残留物全部溶解,并生成一种可燃性气体.则得剩余固体中一定不含有铜.因为铜不能与盐酸反应,生成氢气.故可判断原固体中一定没有氧化铜.那么就只有铁可与盐酸反应,置换出其中的氢气,这样就确定原固体物质中一定含有木炭和氧化铁.
③由于氧化钙也是可与盐酸反应生成可溶于水的氯化钙,没有气体产生的.因此无法确定剩余固体中是否有氧化钙.这样就不能确定原固体中含有碳酸钙.
④由此可得原固体物质中一定含有木炭粉和氧化铁,一定没有氧化铜,可能有碳酸钙.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题。他设计并完成了下表所示的探究实验:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验一 | 将2g氯酸钾加热至熔化,伸入带火星的木条, | 木条复燃 | 氯酸钾受热分解能产生氧气,但是_____。 反应的化学方程式为:
| 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条 | 木条不复燃 | ______________ | |
实验三 | _____________ | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | |
(1)请你帮小明同学填写上表中未填完的空格;
(2)在小明的探究实验中,实验一和实验二起的作用是____________;
(3)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是__________;
第二方面的实验是要_______。
【题目】某学校化学兴趣小组的同学们在实验室发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(提出问题)白色粉末成分的猜想和成因分析。
(做出猜想)①可能是CaCO3:原因是石灰水与空气中的CO2反应。
②可能是___________:原因是溶剂蒸发,石灰水中的溶质结晶析出。
③还可能是Ca(OH)2和CaCO3。
(实验探究)甲同学取白色粉末于试管中,加少量的水、振荡,发现试管底部有白色固体,于是他得出白色粉末是CaCO3的结论。乙同学认为甲同学的结论不严密,理由是______________________。
为了得出较严密的结论,他们进行了下表所示实验,请完成实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 溶液呈红色 | 白色粉末中 ___________________ |
②往上述试管残留的白色固体中加入___________ | ___________ | 白色粉末中含有CaCO3 |
由上述实验可知,白色粉末成分的猜想③是正确的。
(拓展反思)通过上述实验的探究,同学们向实验员提出了保存、使用易变质溶液的下列建议,合理的是_________。
a 密封保存 b 使用前临时配制 c 禁止使用该试剂
【题目】2018年1月11日,广西某地高速公路大桥上用于融冰作业的2包共100公斤含有亚硝酸钠的工业盐遗失,当地迅速组织警力开展搜寻遗失的工业盐,确保不流入市场和家庭。
(资料卡1)亚硝酸钠与食盐氯化钠相似,为白色有咸味的固体,但误食会使人中毒。腌制食品、泡菜等制作过程中会产生亚硝酸钠。
根据以上资料,回答下列问题:
(1)用盐融冰的原理是____,该过程主要发生的是___(填“物理变化”或“化学变化”)。
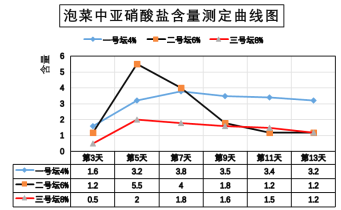
(2)下图是用不同浓度盐水腌制泡菜过程中亚硝酸盐含量测定曲线图。据此回答:当盐水浓度为6%时,第____天亚硝酸盐含量达到最大值。为了安全,泡菜腌制时盐水浓度最好是____并在腌制____天后再食用。
(3)兴趣小组欲测定某工业盐中亚硝酸钠的质量分数
(资料卡2)实验室常用亚硝酸钠与氯化铵溶液反应制取纯净的氮气,其化学方程式为:NaNO2 + NH4Cl ![]() NaCl + N2↑+ 2H2O(此反应是放热反应)
NaCl + N2↑+ 2H2O(此反应是放热反应)
(资料卡3)在酸性环境中高锰酸钾能与亚硝酸钠发生如下反应:2KMnO4 + 5NaNO2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5NaNO3 + 3H2O
(方案一)取1g该工业盐样品与足量氯化铵溶液于如图装置中充分反应(该工业盐中其他成分不与氯化铵溶液反应),实验时加热片刻后,即可移去酒精灯,其原因___。最终量筒中收集到300mL水,已知该条件下氮气的密度为1.25g/L,则该工业盐样品中亚硝酸钠的质量分数为____(写出计算过程,结果保留一位小数,)。
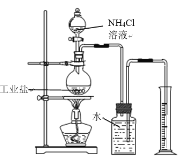
实验结束后发现测量结果偏大,可能原因是____。
(方案二)为更准确地测定该工业盐中亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用含量为15.8g/L的酸性KMnO4溶液进行反应,实验所得数据如下表所示:
实验次序 | 1 | 2 | 3 | 4 |
KMnO4溶液体积(mL) | 20.60 | 20.02 | 20.00 | 19.98 |
上述第____次实验所得数据明显异常,剔除异常数据后,计算出该工业盐中亚硝酸钠的质量分数为___。
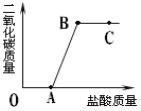
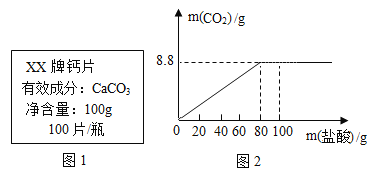
【题目】钙是人体中的常量元素,因缺钙而导致骨质疏松、佝偻病等的患者应在医生的指导下服用钙片。某补钙药剂说明书的部分信息如图1所示。现将100g盐酸分成五等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与关系图如图2.请根据有关信息回答问题。
实验次数 | 第一次 | 第三次 | 第四次 |
加入盐酸的质量(g) | 20 | 20 | 20 |
剩余固体的质量(g) | 35 | a | 20 |
(1)该品牌补钙药剂中CaCO3的质量分数是________,a的数值为________。
(2)该盐酸中溶质的质量分数是多少________?(写出计算过程,计算结果精确至0.1%)