题目内容
将氢气通入到
10g氧化铜粉末中,加热一段时间,冷却后剩余固体物质质量为8.4g,那么下列说法中正确的是[
]|
A .有1.6g水生成 |
B .有8.4g铜生成 |
|
C .该反应中只需要0.2g氢气 |
D .有80%的CuO被还原 |
答案:D
解析:
解析:
|
本题中参加反应的固体反应物质是 CuO,反应后生成的固体物质是Cu.CuO的相对分子质量为80,Cu的相对原子量是64,由反应的化学方程式可知,每80份质量的CuO参加反应,即生成64份质量的Cu,固体质量减少80-64=16份.而本题中反应前固体质量为10g,反应后固体总质量为8.4g,反应后固体质量减少10-8.4=1.6(g).这样,如果我们设有xgCuO参加反应,根据化学方程式列式计算出参加反应的CuO的质量,进而可以求出它占原有氧化铜的质量分数.
同样道理,可以解得 z=6.4g w=1.8g经过分析,我们可以看出,生成水的质量是 1.8g,所以A选项不对;实际生成金属铜的质量是6.4g,所以B选项不符合题意;还原氧化铜所需的氢气质量是0.2g,但实际上所消耗氢气的质量应该是大于这个数值,所以C选项也是错误的,看正确答案只剩下D了,我们再来验证一下:氧化铜被还原的百分数为 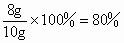 ,所以D答案是正确的. ,所以D答案是正确的. |

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
将氢气通入到
10g氧化铜粉末中,加热一段时间,冷却后剩余固体物质质量为8.4g,那么下列说法中正确的是[
]|
A .有1.6g水生成 |
B .有8.4g铜生成 |
|
C .该反应中只需要0.2g氢气 |
D .有80%的CuO被还原 |
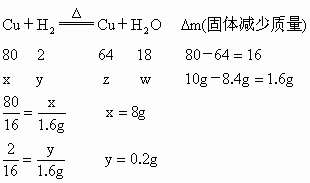
 Cu+H2O)
Cu+H2O)