题目内容
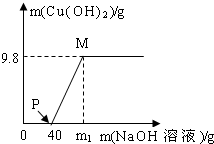
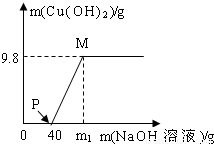
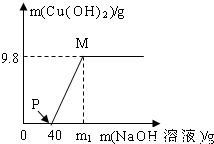
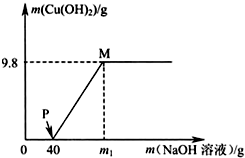
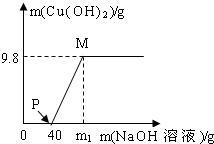 向氯化铜和盐酸的100g混合溶液中,逐滴加入溶质质量分数为10%的氢氧化钠溶液,参加反应的氢氧化钠溶液质量和生成沉淀的质量关系如图,仅考虑沉淀为氢氧化铜.则下列说法正确的是( )
向氯化铜和盐酸的100g混合溶液中,逐滴加入溶质质量分数为10%的氢氧化钠溶液,参加反应的氢氧化钠溶液质量和生成沉淀的质量关系如图,仅考虑沉淀为氢氧化铜.则下列说法正确的是( )| A、整个反应中,氯离子个数减少 | B、P点溶液中的溶质只有一种 | C、M点溶液比P点溶液中氯化钠的质量分数大 | D、沉淀完全时,m1的数值为80 |
分析:A、根据复分解反应的实质来考虑;
B、P点表示氢氧化钠与盐酸恰好反应完,再去考虑溶质是谁;
C、根据溶质质量和溶液质量的变化来考虑;
D、根据沉淀质量算出与氯化铜反应的氢氧化钠的质量,再除以10%算出氢氧化钠溶液质量.
B、P点表示氢氧化钠与盐酸恰好反应完,再去考虑溶质是谁;
C、根据溶质质量和溶液质量的变化来考虑;
D、根据沉淀质量算出与氯化铜反应的氢氧化钠的质量,再除以10%算出氢氧化钠溶液质量.
解答:解:A、复分解反应的实质是能生成气体、水、沉淀的离子参加了反应,即氢离子、氢氧根离子、铜离子、而氯离子实际并没有参加反应,所以整个反应过程中,氯离子个数不变,故A错误.
B、P点表示氢氧化钠与盐酸恰好反应完,但氯化铜还没有反应,此时溶质是氯化铜、氯化钠,故B错误;
C、M点溶液比P点溶液中氯化钠的质量多了因为氢氧化钠与氯化铜反应生成了氯化钠,溶液质量少了,因为生成了沉淀,所以质量分数变大了,故C正确;
D、设生成沉淀质量9.8g时氢氧化钠的质量是x
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
2×(23+16+1)64+(16+1)×2
x 9.8g
=
x=8g 由于该溶液的溶质质量分数=10%,所以所需的氢氧化钠质量为
=80g
所以需氢氧化钠溶液质量为80克,但这是与氯化铜反应需要的氢氧化钠,再加上与盐酸反应的氢氧化钠溶液,所以m>80,故D错误.
故选C.
B、P点表示氢氧化钠与盐酸恰好反应完,但氯化铜还没有反应,此时溶质是氯化铜、氯化钠,故B错误;
C、M点溶液比P点溶液中氯化钠的质量多了因为氢氧化钠与氯化铜反应生成了氯化钠,溶液质量少了,因为生成了沉淀,所以质量分数变大了,故C正确;
D、设生成沉淀质量9.8g时氢氧化钠的质量是x
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
2×(23+16+1)64+(16+1)×2
x 9.8g
| 80 |
| 98 |
| x |
| 9.8g |
x=8g 由于该溶液的溶质质量分数=10%,所以所需的氢氧化钠质量为
| 8g |
| 10% |
所以需氢氧化钠溶液质量为80克,但这是与氯化铜反应需要的氢氧化钠,再加上与盐酸反应的氢氧化钠溶液,所以m>80,故D错误.
故选C.
点评:本题重点考查复分解反应的实质,并要灵活掌握了有关质量分数的计算方法,属于一道溶液综合计算题.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
 29、向氯化铜和盐酸的100g混合溶液中,逐滴加入溶质质量分数为10%的氢氧化钠溶液,参加反应的氢氧化钠溶液质量和生成沉淀的质量关系如图,仅考虑沉淀为氢氧化铜.则下列说法正确的是( )
29、向氯化铜和盐酸的100g混合溶液中,逐滴加入溶质质量分数为10%的氢氧化钠溶液,参加反应的氢氧化钠溶液质量和生成沉淀的质量关系如图,仅考虑沉淀为氢氧化铜.则下列说法正确的是( )