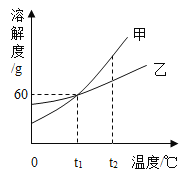
题目内容
【题目】联合国教科文组织将今年定为“化学元素周期表国际年”,以纪念编制元素周期表150周年。如图为锶原子在元素周期表中的相关信息及锶原子的原子结构示意图,据此判断下列说法错误的是
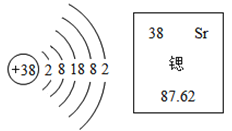
A.锶原子核内的质子数为38
B.锶在元素周期表中位于第二周期
C.锶的相对原子质量是87.62
D.锶原子在化学反应中易失去电子
【答案】B
【解析】
A、图例中左上角的数字表示原子序数,锶原子核内的质子数=原子序数=38;故选项正确,但不符合题意;
B、锶原子核外有5个电子层,在元素周期表中位于第五周期;故选项错误,但符合题意;
C、图例中正下方的数字表示相对原子质量,锶的相对原子质量是87.62;故选项正确,但不符合题意;
D、锶原子最外层有2个电子,小于4;在化学反应中易失去电子;故选项正确,但不符合题意;
故选:B。

 阅读快车系列答案
阅读快车系列答案【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为_______g。
(2)该黄铜中铜的质量分数为多少____________? (写出计算过程)
(3)第三次实验中溶质的种类为________________。
【题目】(1)在化学课上,甲同学将燃烧的钠迅速伸人到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出问题]黑色颗粒和白色物质是什么?
[进行猜想]甲认为黑色颗粒是碳,白色物质可能是Na2O或Na2O和Na2CO3或____________________,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是____________________________________。
[查阅资料]氧化钠为白色粉末,溶于水生成氢氧化钠: ![]() ;常温下饱和Na2CO3溶液的PH值约为12。
;常温下饱和Na2CO3溶液的PH值约为12。
[实验探究]甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ① 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2 溶液 | 出现白色沉淀 | 白色物质是Na2CO3 |
② 静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
[反思评价]丙同学认为方案1得到的结论不正确,其理由是___________________________。
[得出结论]钠在二氧化碳中燃烧的化学方程式为__________________________。
(2)某研究性学习小组设计了用沉淀法测定纯碱( Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案
[实验原理]利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数
[实验步骤]
①托盘天平称取样品22.0g放人烧杯中,加水使其完全溶解
②验证Na2CO3已完全反应的方法是:静置,向上层清液中滴加____________溶液,如果没有白色沉淀生成,即可证明;
③过滤、操作X、干燥、称量沉淀的质量为20.0g,操作X的名称是___________,如果缺少此操作会造成碳酸钠质量分数___________(填“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为多少?_____