题目内容
图是甲、乙两种物质的溶解度曲线,请结合图回答问题:
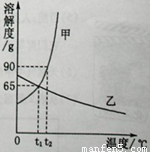
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是 。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数 (填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行以下实验:
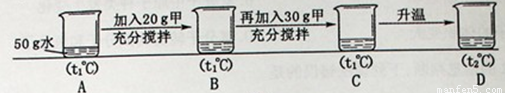
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是 。
⑴t1 ⑵乙 ⑶降温结晶(合理均可)⑷大于
⑸ ①B ②甲物质溶于水时会放出热量,使溶液温度升高,甲物质的溶解度增大。
【解析】(1)甲、乙两种物质的溶解度相等,即两种物质的溶解度曲线相交的点。找出相应的温度即可。应为t1℃。
(2)溶解度随温度升高而降低的物质是乙,溶解度随温度升高而升高的物质是甲。
(3)甲的溶解度随温度升高而升高。要使其从饱和溶液中结晶:方法一使其溶解度降低,即降温结晶;方法二减少溶剂,即蒸发结晶。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液将会有晶体析出,形成的溶液是t1℃的饱和溶液,其100g溶剂对应的溶质质量为65g。乙溶液中将形成t1℃的不饱和溶液,其100g溶剂对应的溶质质量应按乙t2℃时计算,即<65g。所以甲溶液的溶质质量分数将大于乙溶液的溶质质量分数。
(5)①根据图可知,t1℃时甲的溶解度为90g,t2℃甲的溶解度65g。
温度 溶解度 水的
质量 最多可溶解
的固体质量 现有固
体质量 能否完全溶解 未溶解固
体质量 溶液是
否饱和
A t1℃ 65g 50g 32.5g
B t1℃ 65g 50g 32.5g 20g 能 0 否
C t1℃ 65g 50g 32.5g 50g 否 17.5g 是
D t2℃ 90g 50g 45g 50g 否 5g 是
②向B对应的溶液中再加入30g甲固体的过程中,根据上表可知温度不变固体无法全部溶解。题中观察到全部溶解说明溶解应变大了,即温度升高了。一段时间后又有部分固体析出,说明溶解度下降了,即温度又降低了。由此可推测甲溶解时可能会放热。一段时间后,热量散失。据此可进行回答。
考点:溶解度曲线图及意义
点评:本题可根据溶解度曲线的意义来解答。

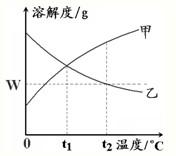 19、如图是甲、乙两种物质的溶解度曲线.在t2℃时向盛有100g水的烧杯中先后加入w g甲 和w g乙(两种物质溶解时互不影响),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( )
19、如图是甲、乙两种物质的溶解度曲线.在t2℃时向盛有100g水的烧杯中先后加入w g甲 和w g乙(两种物质溶解时互不影响),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( )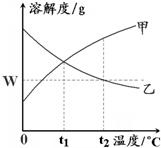 8、如图是甲、乙两种物质的溶解度曲线.在t2℃时往盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响,且溶质仍是甲、乙),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( )
8、如图是甲、乙两种物质的溶解度曲线.在t2℃时往盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响,且溶质仍是甲、乙),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( ) 13、右图是甲、乙两种物质的溶解度曲线,请依据该图判断下列说法正确的是( )
13、右图是甲、乙两种物质的溶解度曲线,请依据该图判断下列说法正确的是( )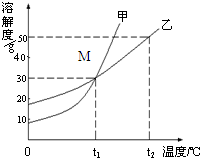 如图是甲、乙两种物质的溶解度曲线图,据此回下列问题:
如图是甲、乙两种物质的溶解度曲线图,据此回下列问题: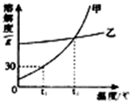 如图是甲、乙两种物质的溶解度曲线,下列说法中正确的是( )
如图是甲、乙两种物质的溶解度曲线,下列说法中正确的是( )