��Ŀ����
����Ŀ���ձ���װ��һ�������������ͭ�Ļ����Һ����֪����Һ�к�H2SO4������Ϊ9.8g��ijͬѧΪ�ⶨ�û����Һ������ͭ�����������ձ�������10%��NaOH��Һ���õ�������������¼���£�
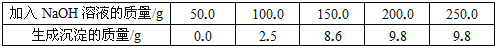
��1���õ�������������Ϊ g���û����Һ������ͭ������Ϊ g��
��2���μӷ�Ӧ��NaOH��Һ���������Ƕ��ٿˣ�(Ҫ��д�����������
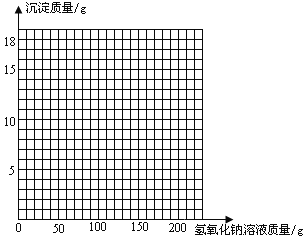
��3�������ڸû����Һ�м���NaOH��Һ���������ɳ��������仯��ϵ�����ߡ�
���𰸡���1��9.8 �� 16����2��160g
��3����ͼ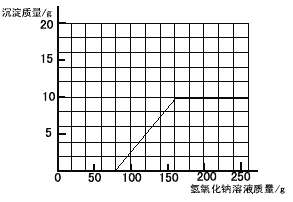
��������
�����������1���ɼ�¼���ݱ���֪��������ͭ��ȫ��Ӧ��������ɫ����9.8g������Һ������ͭ������Ϊx
CuSO4+2NaOH=Na2SO4+Cu��OH��2��
160 98
x 9.8g
160/x=98/9.8g x=16g
��2���������ᷴӦ��NaOH������Ϊy����CuSO4��Ӧ��NaOH������Ϊz��
H2SO4+2NaOH=Na2SO4+2H2O
98 80
9.8g y
98/9.8g=80/y y=8.0g
CuSO4+2NaOH=Cu��OH��2��+Na2SO4
80 98
z 9.8g
98/9.8g=80/z z=8g
�ʲμӷ�Ӧ��NaOH��Һ��������Ϊ��8g+8g��/10%=160g
�������������вμӷ�Ӧ������������Һ����������160����
��3��