题目内容
人们发现,用氯化钯(PdCl2)溶液可检验CO对大气污染情况.CO和PbCl2溶液反应(水参加反应)生成黑色金属钯粉末、二氧化碳和氯化氢,反应的化学方程式为:PdCl2+H2O+CO=Pd↓+CO2+2HCl.现将50L空气(密度为1.29g/L)通过足量的PbCl2溶液,将过滤得到的固体干燥,称其质量为0.106g,求所测定空气中一氧化碳的质量分数是多少?
解:设空气中CO的质量为x
PdCl2+H2O+CO=CO2↑+2HCl+Pd
28 106
x 0.106g
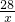 =
=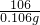 ,
,
解得,x=0.028g
空气中CO的质量分数为: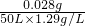 ×100%=0.043%.
×100%=0.043%.
答:所测定空气中一氧化碳的质量分数是0.043%.
分析:根据反应的化学方程式,可确定反应中钯与一氧化碳的质量关系,利用这一质量关系,由反应后得到Pd的质量可计算反应消耗一氧化碳的质量.
点评:本题为根据化学方程式的基础计算,完整的计算过程、规范的书写格式、正确的计算结果是解答此类问题时需要认真对待的.
PdCl2+H2O+CO=CO2↑+2HCl+Pd
28 106
x 0.106g
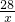 =
=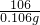 ,
,解得,x=0.028g
空气中CO的质量分数为:
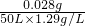 ×100%=0.043%.
×100%=0.043%.答:所测定空气中一氧化碳的质量分数是0.043%.
分析:根据反应的化学方程式,可确定反应中钯与一氧化碳的质量关系,利用这一质量关系,由反应后得到Pd的质量可计算反应消耗一氧化碳的质量.
点评:本题为根据化学方程式的基础计算,完整的计算过程、规范的书写格式、正确的计算结果是解答此类问题时需要认真对待的.

练习册系列答案
相关题目