题目内容
(2010?杨浦区二模)“黄铜”是铜锌合金,具有较高机械性能,比纯铜耐腐蚀.现取20.0g某种黄铜投入l00g某浓度的稀硫酸中,完全反应后得到氢气0.1mol.请计算:①该黄铜含锌的物质的量是______mol(根据化学方程式列式计算).
②剩余溶液的质量______g (写出计算过程).
【答案】分析:①“黄铜”中的铜金属活动性在(H)后,不能与稀硫酸反应,故该黄铜中只有锌与稀硫酸发生反应;根据反应的化学方程式和氢气的量,列出比例式,就可计算出该黄铜含锌的物质的量;
②因为反应中有气体生成,故剩余溶液的质量=参与反应的锌的质量+稀硫酸质量-生成氢气的质量.
解答:解:①设:黄铜中含Zn为xmol,
Zn+H2SO4→ZnSO4+H2↑
1 1
x 0.1
∴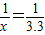
解之得:X=0.1mol;
②m(Zn)=0.1×65=6.5g,m(H2)=0.1×2=0.2g;
m(溶液)=6.5g+100g-0.2g=106.3g.
故答案为:①0.1;②106.3.
点评:本题主要考查学生运用化学方程式和金属活动性综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.本题涉及摩尔质量的计算,对初中学生来说,是较难的试题.
②因为反应中有气体生成,故剩余溶液的质量=参与反应的锌的质量+稀硫酸质量-生成氢气的质量.
解答:解:①设:黄铜中含Zn为xmol,
Zn+H2SO4→ZnSO4+H2↑
1 1
x 0.1
∴
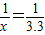
解之得:X=0.1mol;
②m(Zn)=0.1×65=6.5g,m(H2)=0.1×2=0.2g;
m(溶液)=6.5g+100g-0.2g=106.3g.
故答案为:①0.1;②106.3.
点评:本题主要考查学生运用化学方程式和金属活动性综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.本题涉及摩尔质量的计算,对初中学生来说,是较难的试题.

练习册系列答案
相关题目
