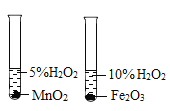题目内容
【题目】回答下列与含碳物质有关的问题。
(1)普通干电池采用石墨作为电极材料,是利用其优良的__________性;
(2)天然气的主要成分是甲烷,写出甲烷燃烧的化学方程式________________。
(3)酒精是______(“可再生”或“不可再生”)能源,以一定比例添加到汽油里,成为乙醇汽油,其优点是________ 。
【答案】导电 CH4+2O2![]() CO2+2H2O 可再生 节约能源、环保(合理即可)
CO2+2H2O 可再生 节约能源、环保(合理即可)
【解析】
(1)普通干电池采用石墨作为电极材料,是利用其优良的导电性;
(2)天然气的主要成分是甲烷,甲烷燃烧生成水和二氧化碳,反应的化学方程式为:CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(3)乙醇可用高粱、玉米、薯类为原料,经过发酵蒸馏制得,属于可再生能源。使用乙醇汽油的优点是节约能源、环保等。

【题目】二氧化锰可作过氧化氢溶液分解的催化剂,兴趣小组想探究过氧化氢分解有没有其他催化剂,以及影响过氧化氢分解速率的因素除催化剂外还有哪些。
Ⅰ.(提出问题)氧化铁能否作过氧化氢分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
①分别取5mL5%过氧化氢溶液放入A、B两支试管中,向A中加入1g氧化铁粉末,并分别在A、B试管中插入带火星的木条,观察现象。 | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象。 |
②待A中没有现象发生时,重新加入过氧化氢溶液,把带火星的木条伸入试管,如此反复3次。 | 试管中均产生气泡,带火星的木条均复燃。 |
③将步骤②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量为ag。 |
|
④分别取5mL5%过氧化氢溶液放入C、D两支试管中,向C中加入1g氧化铁粉末,向D中加入1g二氧化锰粉末,观察现象。 |
|
(实验结论)
(1)步骤②证明氧化铁的___在反应前后没有发生变化;③中如果a=___,证明氧化铁的___在反应前后没有发生变化。由①②③可知,氧化铁可以作过氧化氢分解的催化剂。
(2)写出试管A中发生反应的文字表达式___。
(实验评价)
设计实验步骤④的目的是___,若观察到D试管中产生气泡的速率比C试管中快,由此可以得到的结论是___。
Ⅱ.探究过氧化氢溶液浓度对过氧化氢分解速率的影响。
(交流讨论)可以通过测定相同条件下不同浓度过氧化氢溶液___来探究。
A 产生相同体积氧气的时间 B 产生氧气的总体积 C 单位时间内产生氧气的体积
(实验探究)
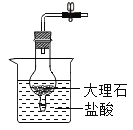
按图1装置进行实验:水浴温度控制在21℃,二氧化锰均为0.5g,过氧化氢溶液均为5mL,三颈瓶容积为250mL,恒压漏斗(漏斗的支管与三颈瓶相连)的作用是使过氧化氢溶液自行下滴。数字传感器数据绘制图像如图2、图3。
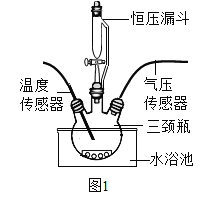

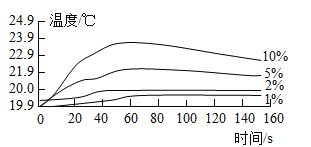
(实验结论)
图2说明过氧化氢溶液浓度与反应速率之间的关系是____,结合图3,以10%H2O2溶液为例分析,三颈瓶内气压后来慢慢降低的原因是_____。