题目内容
下列方案合理的是
| A.制备NaOH溶液:将饱和的纯碱溶液与适量的石灰水混合后过滤 |
| B.检验碳酸根离子:将要检验的物质与稀盐酸混合,观察是否产生气泡 |
| C.鉴别O2、N2、CO2三种气体:分别将燃着的木条伸入集气瓶内,观察现象 |
| D.验证质量守恒定律:选用CuSO4溶液与NaOH溶液,比较混合前后溶液的质量 |
A、D
解析试题分析:A、饱和的纯碱溶液与适量的石灰水混合后,发生反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,过滤后,可以得到NaOH溶液,正确,B、检验碳酸根离子,所需试剂:稀盐酸、澄清石灰水,先将要检验的物质与稀盐酸混合,再将产生的气体通入澄清石灰水中,看是否变浑浊,因为物质与稀盐酸混合产生的气体还有可能是氢气,错误,C、鉴别O2、N2、CO2三种气体:分别将燃着的木条伸入集气瓶内,不可以,因为N2、CO2都不能燃烧,也不支持燃烧,都能使燃着的木条熄灭,错误,D、验证质量守恒定律的时候,最好选择没有气体参加或生成的反应,否则得不易得出正确的结论,而CuSO4溶液与NaOH溶液反应没有产生气体,可以,正确,故选A、D
考点:NaOH的制备,碳酸根离子的检验,O2、N2、CO2三种物质的鉴别,质量守恒定律的探究

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
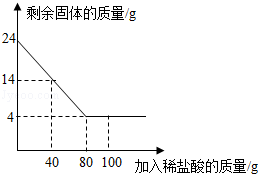
化肥对提高农作物的产量具有重要的作用,碳铵(碳酸氢铵)就是农民朋友经常使用的一种氮肥,碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气。某校化学兴趣小组为测定某碳铵肥料样品的纯度,将8.5g样品加入足量的浓氢氧化钠溶液中共热,(碳铵中的杂质不与氢氧化钠反应,反应的方程式为NH4HCO3+2NaOH = Na2CO3+2H2O+NH3↑),把产生的所有NH3用足量的硫酸溶液吸收,同时测量两分钟内硫酸溶液增加的质量,结果如下表所示。
| 时间/S | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
试回答下列问题:
(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是___________________。
(2)请在坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为_________________。
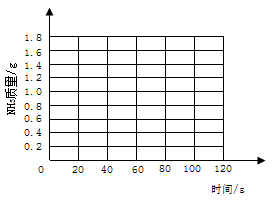
(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数)。
一般可以用向下排空气法收集的是
| A.CO2 | B.H2 | C.CO | D.O2 |
下列几种气体可用下图所示装置干燥、收集的正确组合是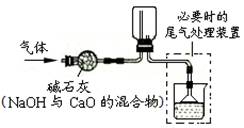
①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3
| A.①⑤⑥ | B.②③⑤ |
| C.③④⑥ | D.①②③ |
某气体能用排水法收集又能用向下排空气法收集,则该气体应具有( )
| A.易溶于水,密度比空气小 | B.难溶于水,密度比空气小 |
| C.易溶于水,密度比空气大 | D.难溶于水,密度比空气大 |
如图是实验室制取二氧化碳的装置,其中的错误有( )
| A.1处 | B.2处 | C.3处 | D.4处 |