题目内容
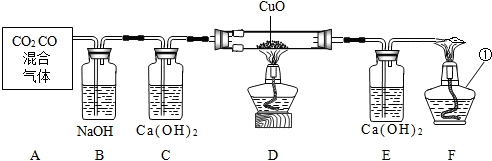
现有CO和CO2的混合气体20g,其中氧元素的质量分数为64%.先使该混合气体通过足量灼热的氧化铁,再通入足量的澄清石灰水中,生成沉淀的质量为 g.(假设各步均完全反应)
【答案】分析:先根据混合气体20g中氧元素的质量分数为64%,推算出含碳元素的质量分数,再根据碳元素都进入了碳酸钙中,根据碳元素的质量算出碳酸钙的质量.
解答:解:由CO和CO2的混合气体20g中氧元素的质量分数为64%,可推出碳元素的质量分数为:20g×(1-64%)=7.2g,根据一氧化碳与氧化铁反应生成铁和二氧化碳,将原来的二氧化碳和新生成的二氧化碳都通入石灰水中得到碳酸钙沉淀和水,所以碳酸钙中的碳元素都来自于一开始的一氧化碳和二氧化碳,所以碳酸钙中碳元素的质量为7.2g,设碳酸钙的质量为X则:X× =7.2g解得X=60g.
=7.2g解得X=60g.
故答案为:60
点评:解答本题的关键是元素守恒,要知道碳酸钙中碳元素的质量来自于一氧化碳和二氧化碳中的碳元素,再根据所提供的信息进行进一步计算.
解答:解:由CO和CO2的混合气体20g中氧元素的质量分数为64%,可推出碳元素的质量分数为:20g×(1-64%)=7.2g,根据一氧化碳与氧化铁反应生成铁和二氧化碳,将原来的二氧化碳和新生成的二氧化碳都通入石灰水中得到碳酸钙沉淀和水,所以碳酸钙中的碳元素都来自于一开始的一氧化碳和二氧化碳,所以碳酸钙中碳元素的质量为7.2g,设碳酸钙的质量为X则:X×
 =7.2g解得X=60g.
=7.2g解得X=60g.故答案为:60
点评:解答本题的关键是元素守恒,要知道碳酸钙中碳元素的质量来自于一氧化碳和二氧化碳中的碳元素,再根据所提供的信息进行进一步计算.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目