题目内容
现有4.9g MgO、Mg(OH)2的固体混合物,与100g 9.8%的稀H2SO4恰好完全反应,形成不饱和溶液.则原固体混合物中镁元素的质量为
- A.1.2g
- B.1.6g
- C.2.4g
- D.4.8g
C
分析:将氢氧化镁与氧化镁组成的混合物投入到稀硫酸中,氢氧化镁、氧化镁都会与稀硫酸发生反应生成硫酸镁,根据硫酸的质量可求出生成的硫酸镁的质量,由硫酸镁的质量可求出镁元素的质量,反应前后元素质量不变,硫酸镁中镁元素的质量即为固体混合物中镁元素的质量.
解答:设固体混合物中镁元素的质量为x
由Mg0+H2SO4=MgSO4 +H2O
Mg(OH)2+H2SO4=MgSO4+2 H2O可得关系式
H2SO4 ~MgSO4 ~Mg
98 24
100g×9.8% x
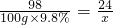
x=2.4g
故选C
点评:本题主要考查了有关化学方程式的计算和有关溶液中溶质质量分数的计算,利用化学反应找出镁元素与硫酸之间的关系是解答关键,注意元素守恒思想的应用.
分析:将氢氧化镁与氧化镁组成的混合物投入到稀硫酸中,氢氧化镁、氧化镁都会与稀硫酸发生反应生成硫酸镁,根据硫酸的质量可求出生成的硫酸镁的质量,由硫酸镁的质量可求出镁元素的质量,反应前后元素质量不变,硫酸镁中镁元素的质量即为固体混合物中镁元素的质量.
解答:设固体混合物中镁元素的质量为x
由Mg0+H2SO4=MgSO4 +H2O
Mg(OH)2+H2SO4=MgSO4+2 H2O可得关系式
H2SO4 ~MgSO4 ~Mg
98 24
100g×9.8% x
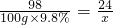
x=2.4g
故选C
点评:本题主要考查了有关化学方程式的计算和有关溶液中溶质质量分数的计算,利用化学反应找出镁元素与硫酸之间的关系是解答关键,注意元素守恒思想的应用.

练习册系列答案
相关题目