题目内容
为了对海水中的氯化物(假设以氯化钠计算)进行成分分析,甲乙丙三位同学分别进行实验,有关数据如下:| 甲 | 乙 | 丙 | |
| 所取海水样品质量/g | 100 | 50 | 50 |
| 加入硝酸银溶液的质量/g | 50 | 50 | 75 |
| 反应后所得沉淀的质量/g | 1.435 | 1.435 | 1.435 |
(2)计算海水中的氯化物(假设以氯化钠计算)的质量分数是多少.
【答案】分析:(1)分析数据表中所取海水样品质量与加入硝酸银溶液质量的关系,根据生成沉淀量相同的特点,判断两种溶液恰好完全反应的实验.
(2)根据生成沉淀的质量,由反应的化学方程式计算海水中氯化钠的质量,进而计算出海水中的氯化物(以氯化钠计算)的质量分数即可.
解答:解:(1)根据甲、乙两同学的实验数据,50g海水与硝酸银溶液完全反应生成沉淀1.435g;乙、丙两同学的实验数据相比,50g硝酸银溶液与海水完全反应生成成沉淀1.435g;综合以上分析,生成1.435g沉淀需要50g海水与50g硝酸银溶液完全反应,所以乙同学两溶液恰好完全反应;故答案为:乙.
(2)设50g海水中含氯化钠的质量为x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 1.435g
 x=0.585g
x=0.585g
海水中的氯化物(以氯化钠计算)的质量分数=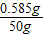 ×100%=1.17%
×100%=1.17%
答:海水中的氯化物(以氯化钠计算)的质量分数为1.17%.
点评:本题难度较大,能够利用表格中的数据对比分析三次实验中海水样品质量与所加硝酸银溶液质量的变化来分析恰好完全反应的实验是解答本题的关键.
(2)根据生成沉淀的质量,由反应的化学方程式计算海水中氯化钠的质量,进而计算出海水中的氯化物(以氯化钠计算)的质量分数即可.
解答:解:(1)根据甲、乙两同学的实验数据,50g海水与硝酸银溶液完全反应生成沉淀1.435g;乙、丙两同学的实验数据相比,50g硝酸银溶液与海水完全反应生成成沉淀1.435g;综合以上分析,生成1.435g沉淀需要50g海水与50g硝酸银溶液完全反应,所以乙同学两溶液恰好完全反应;故答案为:乙.
(2)设50g海水中含氯化钠的质量为x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 1.435g
 x=0.585g
x=0.585g海水中的氯化物(以氯化钠计算)的质量分数=
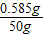 ×100%=1.17%
×100%=1.17%答:海水中的氯化物(以氯化钠计算)的质量分数为1.17%.
点评:本题难度较大,能够利用表格中的数据对比分析三次实验中海水样品质量与所加硝酸银溶液质量的变化来分析恰好完全反应的实验是解答本题的关键.

练习册系列答案
相关题目
为了对海水中的氯化物(假设以氯化钠计算)进行成分分析,甲乙丙三位同学分别进行实验,有关数据如下:
(1)两溶液恰好完全反应的是______
(2)计算海水中的氯化物(假设以氯化钠计算)的质量分数是多少.
| 甲 | 乙 | 丙 | |
| 所取海水样品质量/g | 100 | 50 | 50 |
| 加入硝酸银溶液的质量/g | 50 | 50 | 75 |
| 反应后所得沉淀的质量/g | 1.435 | 1.435 | 1.435 |
(2)计算海水中的氯化物(假设以氯化钠计算)的质量分数是多少.
为了对海水中的氯化物(假设以氯化钠计算)进行成分分析,甲乙丙三位同学分别进行实验,有关数据如下:
(1)两溶液恰好完全反应的是______
(2)计算海水中的氯化物(假设以氯化钠计算)的质量分数是多少.
| 甲 | 乙 | 丙 | |
| 所取海水样品质量/g | 100 | 50 | 50 |
| 加入硝酸银溶液的质量/g | 50 | 50 | 75 |
| 反应后所得沉淀的质量/g | 1.435 | 1.435 | 1.435 |
(2)计算海水中的氯化物(假设以氯化钠计算)的质量分数是多少.