题目内容
 化学是研究物质的组成、结构、性质及变化规律的科学.
化学是研究物质的组成、结构、性质及变化规律的科学.(1)铜、干冰、氯化钠3种物质中,由离子构成的是
(2)食醋中含有醋酸(CH3COOH),醋酸由
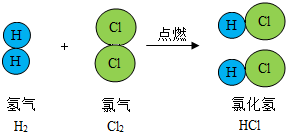
(3)根据如图中蕴含知识回答:
①反应的化学方程式为
②生成物
③反应中各物质质量比为
(4)为维护食品安全,卫生部禁止在面粉中添加增白剂,如过氧化钙(CaO2)等.Ca(OH)2和H2O2在有水存在的条件下生成CaO2?8H2O,它在120℃时完全分解为CaO2等.有关化学反应方程式为:①
分析:(1)金属是原子直接构成的,非金属氧化物是分子构成的,而含金属的化合物一般是离子构成的.
(2)根据化学式进行元素的组成以及微粒个数计算即可.
(3)从图中读取信息,凡是连在一起的原子构成的是分子,注意排除不参加反应的微粒的干扰.至于HCl的溶解性,要根据盐酸推断,盐酸是氯化氢溶解于水得到的,浓度还很大,所以HCl是易溶的.
(4)本题是信息型方程式的书写,关键时找到对应的反应物和生成物,之后是配平.
(2)根据化学式进行元素的组成以及微粒个数计算即可.
(3)从图中读取信息,凡是连在一起的原子构成的是分子,注意排除不参加反应的微粒的干扰.至于HCl的溶解性,要根据盐酸推断,盐酸是氯化氢溶解于水得到的,浓度还很大,所以HCl是易溶的.
(4)本题是信息型方程式的书写,关键时找到对应的反应物和生成物,之后是配平.
解答:解:
(1)铜是原子构成的;干冰是分子构成的;氯化钠是离子构成的.干冰升华时吸收大量的热,导致水蒸气冷凝聚积而降雨.
(2)CH3COOH是由碳氢氧三种元素组成的,其中氢氧原子个数比为4:2=2:1.
(3)由图中还可以看出,是双原子分子的氢气和双原子分子的氯气生成了HCl气体,其化学方程式为H2+Cl2
2HCl.由于HCl溶解于水可以得到高浓度的盐酸,所以HCl一定是易溶于水的,其水溶液是盐酸,所以pH<7.
H2+Cl2
2HCl
2 71 73
所以质量比为2:71:73.
(4)Ca(OH)2和H2O2在有水存在的条件下生成CaO2?8H2O,反应物为Ca(OH)2和H2O2和水,生成物为CaO2?8H2O,对应方程式为Ca(OH)2+H2O2+6H2O═CaO2?8H2O.CaO2?8H2O在120℃时完全分解为CaO2等,根据化学式可以判断应该还同时生成了水,其方程式为CaO2?8H2O
CaO2+8H2O.
故答案为(1)氯化钠;干冰;(2)3;2:1;(3)①H2+Cl2
2HCl;②易;<③2:71:73
(4)①Ca(OH)2+H2O2+6H2O═CaO2?8H2O,②CaO2?8H2O
CaO2+8H2O.
(1)铜是原子构成的;干冰是分子构成的;氯化钠是离子构成的.干冰升华时吸收大量的热,导致水蒸气冷凝聚积而降雨.
(2)CH3COOH是由碳氢氧三种元素组成的,其中氢氧原子个数比为4:2=2:1.
(3)由图中还可以看出,是双原子分子的氢气和双原子分子的氯气生成了HCl气体,其化学方程式为H2+Cl2
| ||
H2+Cl2
| ||
2 71 73
所以质量比为2:71:73.
(4)Ca(OH)2和H2O2在有水存在的条件下生成CaO2?8H2O,反应物为Ca(OH)2和H2O2和水,生成物为CaO2?8H2O,对应方程式为Ca(OH)2+H2O2+6H2O═CaO2?8H2O.CaO2?8H2O在120℃时完全分解为CaO2等,根据化学式可以判断应该还同时生成了水,其方程式为CaO2?8H2O
| ||
故答案为(1)氯化钠;干冰;(2)3;2:1;(3)①H2+Cl2
| ||
(4)①Ca(OH)2+H2O2+6H2O═CaO2?8H2O,②CaO2?8H2O
| ||
点评:信息型方程式的书写主要是找到对应的生成物和反应物以及反应条件,最后注意配平即可.读图题注意排除干扰.

练习册系列答案
相关题目

 化学是研究物质的组成、结构、性质及其变化规律的基础自然科学,请回答下列问题:
化学是研究物质的组成、结构、性质及其变化规律的基础自然科学,请回答下列问题: