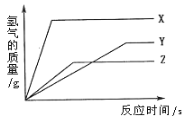
题目内容
【题目】某工厂废液中含有CuSO4(其他成分不含铜元素),现按以下流程回收金属铜。

(1)回收过程中,加入适量稀硫酸可除去过量铁屑,该反应的化学方程是_____。
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是(用方程式表示)_____。
(3)现有一批废液,其中含4tCuSO4,理论上可从该废液中回收得到多少吨金属铜_____?
【答案】![]()
![]() 1.6t
1.6t
【解析】
往含有硫酸铜的废液中加入过量铁屑,铁屑会置换出铜单质,过滤后滤渣成分为铁和铜,加入适量稀硫酸后,铜金属活动性弱,不能反应;铁可与稀硫酸反应,铁粉溶解,过滤得到Cu,洗涤干燥后得到金属铜。
(1)活泼金属可与酸反应产生氢气,因此铁屑与稀硫酸的化学方程式为:![]() 。
。
(2)铜在加热条件下与氧气反应产生氧化铜,因此洗涤后的滤渣不能用加热的方法干燥,原理是:![]() 。
。
(3)设可回收铜的质量为x,
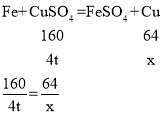
x=1.6t,故可回收1.6t铜。

【题目】如下图(夹持仪器已略),某兴趣小组在老师指导下,探究铁与水蒸气的反应,请回答。
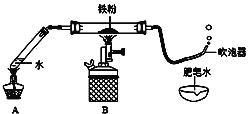
【实验初探】
(1)连接装置,并___________。
(2)装好药品。
(3)加热一段时间后,吹泡器连续吹出气泡,且气泡向上飞起,用燃着的木条靠近气泡,能产生爆鸣。
该气体燃烧的化学方程式为________。
【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4)。
①它们都不溶于水,其中铁粉、Fe3O4能被磁铁吸引;②FeO接触到空气会立即由黑色变为红棕色;③三种氧化物都不与硫酸铜溶液反应,但能与酸反应生成可溶性物质。
【实验探究】实验小组同学对反应后的剩余固体进行探究。
(1)小梅发现固体为黑色,由此判断:固体中肯定不存在Fe2O3 ,理由是_______。
(2)小宇发现固体均能被磁铁吸引,大家倒出玻璃管中黑色固体,平铺于白纸上。观察现象是__________,判断黑色固体中一定没有FeO。
讨论:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
【提出猜想】玻璃管中黑色固体成分有什么?
猜想Ⅰ:Fe; 猜想Ⅱ:Fe3O4; 猜想Ⅲ:______________
实验步骤 | 实验现象 | 实验结论 |
取上述固体少许,加入足量 _________________ | 出现红色固体,且有黑色固体残留 | 黑色固体中一定含有 ________________ |
【结论反思】(1)铁与水蒸气发生置换反应,反应的方程式是________________。
(2)出现红色固体的化学方程式是_______,加入的溶液必须足量的原因是______________。