题目内容
(2013?平原县二模)氯化镁在化工、冶金、食品、医药等领域都有广泛的应用,是一种重要的原材料.某学习小组同学们在学习了酸碱盐的知识以后,对生成氯化镁的方法加以归纳和整理,如图所示:

请回答下列问题:
(1)写出下列反应的化学方程式:①
(2)X、Y是常见的盐类物质,试推断它们的化学式:X

请回答下列问题:
(1)写出下列反应的化学方程式:①
Mg+2HCl=MgCl2+H2↑
Mg+2HCl=MgCl2+H2↑
;③Mg(OH)2+2HCl=MgCl2+2H2O
Mg(OH)2+2HCl=MgCl2+2H2O
.(2)X、Y是常见的盐类物质,试推断它们的化学式:X
MgCO3
MgCO3
、YBaCl2
BaCl2
.分析:(1)根据化学方程式的书写方法考虑方程式的书写;(2)根据盐是电离出金属离子和酸根离子的化合物,再结合复分解反应发生的条件分析.
解答:解:(1)①反应的反应物是镁和盐酸,生成物是氯化镁和氢气,用观察法配平,氢气后面标上上升符号,所以方程式是:Mg+2HCl=MgCl2+H2↑;③反应的反应物是氢氧化镁和盐酸,生成物是氯化镁和水,用观察法配平,所以方程式是:Mg(OH)2+2HCl=MgCl2+2H2O;
(2)X与盐酸反应生成氯化镁,且X是盐类物质,根据质量守恒定律可知X是含镁的盐即:碳酸镁即可;硫酸镁和Y反应生成氯化镁,Y也是盐类物质,盐和盐反应发生的是复分解反应,根据质量守恒定律可知Y中含有氯元素,还需要符合复分解反应的条件,由于硫酸钡是白色沉淀,所以Y属于氯化钡即可.
故答案为:(1)①Mg+2HCl=MgCl2+H2↑; ③Mg(OH)2+2HCl=MgCl2+2H2O;(2)X:MgCO3; Y:BaCl2.
(2)X与盐酸反应生成氯化镁,且X是盐类物质,根据质量守恒定律可知X是含镁的盐即:碳酸镁即可;硫酸镁和Y反应生成氯化镁,Y也是盐类物质,盐和盐反应发生的是复分解反应,根据质量守恒定律可知Y中含有氯元素,还需要符合复分解反应的条件,由于硫酸钡是白色沉淀,所以Y属于氯化钡即可.
故答案为:(1)①Mg+2HCl=MgCl2+H2↑; ③Mg(OH)2+2HCl=MgCl2+2H2O;(2)X:MgCO3; Y:BaCl2.
点评:熟练掌握酸的化学性质与酸碱盐之间的反应规律、复分解反应发生的条件是解答本题的关键.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
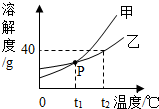 (2013?平原县二模)图是甲、乙两种固体物质的溶解度曲线图,下列说法正确的是( )
(2013?平原县二模)图是甲、乙两种固体物质的溶解度曲线图,下列说法正确的是( )