题目内容
【题目】下列四种粒子的结构示意图中,表示金属元素原子的是( )
A.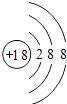
B.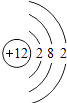
C.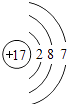
D.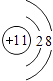
【答案】B
【解析】解:A、原子最外层电子数为8(氦为2 ),且核电荷数=质子数=核外电子数=18,为原子;属于稀有气体元素;故A错误; B、最外层电子数为2,少于4,且核电荷数=质子数=核外电子数=12,为金属元素原子;故B正确;
C、最外层电子数为7,大于4,且核电荷数=质子数=核外电子数=17,为非金属元素原子;故C错误;
D、最外层电子数为8,且核电荷数=质子数=11>核外电子数=10,为阳离子;故D错误;
故选B.
根据原子结构示意图的特点:稀有气体元素,原子最外层电子数为8(氦为2);金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;
根据当核电荷数=质子数=核外电子数,为原子;
根据当核电荷数=质子数>核外电子数,为阳离子;
当核电荷数=质子数<核外电子数,为阴离子;进行解答.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
【题目】某同学为了测定某铜铁混合物中铜的质量分数,先取相同质量的混合物分别置于三个等质量(100g)的烧杯中,再分别加入稀硫酸充分反应,有关实验数据如下:
第1杯 | 第2杯 | 第3杯 | |
混和物质量 | 20g | 20g | 20g |
稀硫酸质量 | 50g | 100g | 150g |
反应后烧杯及其中物质质量 | 169.8g | 219.6g | 269.6g |
请计算:
(1)反应结束后第二个烧杯中产生的气体是克.
(2)混合物中铜的质量分数为多少?
(3)向实验后的第三杯溶液中加入足量的铁粉,完全反应后过滤,将所得的滤液配成10%的FeSO4溶液,需要向滤液中加入多少克水?(假设实验过程中溶液损失忽略不计)