题目内容
【题目】白铜(Cu 、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。如图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。
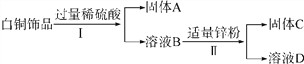
已知溶液B中含有一种二价金属的硫酸化合物,溶液D中只有一种溶质。
分析该流程,回答下列问题:
(1)固体A的化学式为__________,过程Ⅱ中的实验操作名称是____________。
(2)过程Ⅰ中反应的化学方程式为____________________________________________。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是________________________。
【答案】 Cu 过滤 Ni+H2SO4===NiSO4+H2↑ Zn、Ni、Cu
【解析】(1). 白铜为Cu、Ni合金,在金属活动性顺序表中,铜在氢后,铜不与酸反应,故加入过量稀硫酸后剩余的固体为铜; (2). 过程Ⅱ中的实验操作目的是将难溶性固体与液体分离,所以应为过滤 ;(3). 加硫酸时,硫酸与镍反应生成硫酸镍和氢气,反应方程式为:Ni+H2SO4===NiSO4+H2↑;(4).镍与酸反应,证明镍在氢前,即在铜前,锌能与硫酸镍反应,证明锌的活动性比镍强,故三种金属活动性由强到弱的顺序是: Zn、Ni、Cu

练习册系列答案
相关题目