题目内容
【题目】工业上制备K2SO4晶体的工艺流程图如下。
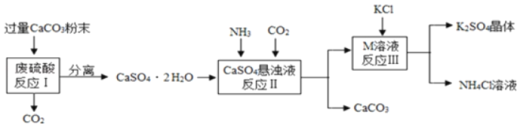
请根据流程回答问题:
(1)将CaCO3研成粉末的目的是_____。
(2)写出反应Ⅰ中的化学方程式_____。
(3)上述流程中可循环使用的物质有CaCO3和_____(填化学式)。
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是_____。
【答案】增大反应物的接触面积,利于充分反应 CaCO3+H2SO4=CaSO4+H2O+CO2↑ CO2 减少K2SO4的溶解
【解析】
(1)研成粉末能增大反应物的接触面积,利于充分反应,故填增大反应物的接触面积,利于充分反应。
(2)反应Ⅰ中的反应是碳酸钙与硫酸反应生成硫酸钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+H2SO4=CaSO4+H2O+CO2↑。
(3)根据既是反应物,也是生成物的物质,可以循环使用,根据图示可知反应Ⅰ中生成的二氧化碳和反应Ⅱ生成的碳酸钙可以循环利用,故填CaCO3、CO2。
(4)饱和硫酸钾溶液不能继续溶解硫酸钾,不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是减少K2SO4的溶解,故填减少K2SO4的溶解。

【题目】化学实验课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图):

[提出问题]这瓶试剂可能是什么溶液呢?
[做出猜想]第一组:可能是CaO溶液
第二组:可能是CaCO3溶液
第三组:可能是CaCl2溶液
第四组:可能是Ca(OH)2溶液
第五组:可能是Ca(NO3)2溶液
[交流讨论]讨论后,大家一致认为第一组和第二组的猜想不正确。
第一组猜想不正确的原因是_____(用化学方程式表示);
第二组的猜想不正确的原因_____。
[査阅资料]CaCl2溶液和Ca(NO3)2溶液均为中性.
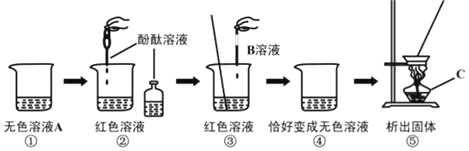
[实验探究]
实验方案 | 滴加酚酞溶液 | 吹入CO2气体 | 滴加X溶液 |
实验操作 |
|
|
|
实验现象 | ②_____ | 没有白色沉淀 | 产生白色沉淀 |
实验结论 | 第四组猜想不成立 | ③第_____组猜想不成立 | 第三组猜想成立 |
根据实验现象和结论,滴加ⅹ溶液后发生反应的化学方程式为_____。
[得出结论]第三组猜想成立,此无色溶液为CaCl2溶液.
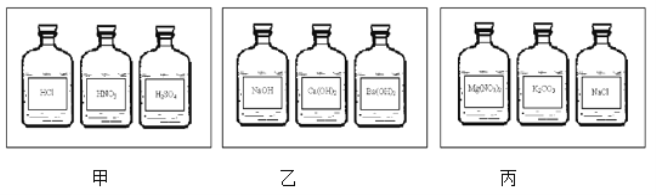
[反思应用]探究结束后,同学们给该试剂重新贴上标签,请你帮助分析这瓶试剂应该放到下列哪一个药品柜中?_____(填序号).