题目内容
“溶液”在日常生产生活中应用广泛,因而我们要掌握一些有关“物质溶解”的知识.(1)20℃时,17gKCl溶解在50g水中恰好达到饱和,则该温度下KCl的溶解度为
(2)相同条件下,氢氧化铜难溶于水,高锰酸钾易溶于水,说明固体物质的溶解能力和溶质的性质有关;请你举例说明固体物质的溶解能力还与什么因素有关?
| 影响固体物质的溶解能力 | 举例说明 |
A.氧化钙B.硝酸铵 C.氢氧化钠D.氯化钠)
(4)如图为氯化铵和硫酸钠的溶解度曲线,当把相同质量的氯化铵和硫酸钠的饱和溶液从50℃降到20℃时,析出晶体最多的是
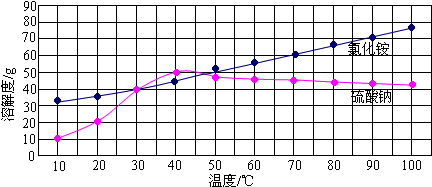
(5)在40℃时取两份100g水分别往加入50克氯化铵和50克硫酸钠,充分搅拌后,升温到60℃,下列说法正确的是
A.40℃时,两溶液均为饱和溶液
B.40℃时,两溶液质质量分数相等
C.50℃时.两溶液仍为饱和溶液
D.60℃时,硫酸钠溶液仍为饱和溶液,氯化铵溶液为不饱和溶液
E.60℃时,两溶液溶质质量分数相等
F.60℃时,两溶液中溶质质量分数不相等.
(2)固体物质的溶解能力与溶质的性质、溶剂的性质有关
(3)物质溶解有吸热或放热现象
(4)有关由溶解度曲线图可知,不同物质在同一温度下的溶解度的大小关系.也可知,同一物质在不同温度下的溶解度的大小关系.溶解度曲线的相交点表示在此温度下两物质的溶解度相等.
| X |
| 100g |
| 17g |
| 50g |
X═34g
故答案为:34g
(2)固体物质的溶解能力与溶质的性质、溶剂的性质、温度有关;故答案为:油不溶于水,但能溶于汽油;等量的水温度越高溶解的硝酸钾越多
(3)物质溶解有吸热或放热现象;故答案为:增大、洗衣粉溶于水放热;A、C
(4)有关由溶解度曲线图可知,氯化铵和硫酸钠的混合饱和溶液从50℃降到20℃时,硫酸钠的溶解度变化大,所以硫酸钠析出的溶质多.故答案为:硫酸钠;A、D、F
| 溶解度 |
| 100 |
| 溶质质量 |
| 溶剂质量 |
| 溶解度 |
| 100+溶解度 |
| 溶质质量 |
| 溶液质量 |

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案(09苏州)(8分)在日常生活中,我们发现切过咸菜的刀更容易生锈.而除锈用稀盐酸比稀硫酸快。为了进一步验证上述现象,某校师生做了以下相关分组实验,请你根据自己平时课堂学习的体验一起参与讨论并回答相关问题。
【步骤一】未打磨的铝片浸入氯化铜溶液中,迅速产生大量气泡和疏松的紫红色固体,并放热,片刻后溶液由蓝绿色变成无色。
(1)若要正视紫红色固体中是否含有氧化铜,可用 ▲ 溶液(填一试剂)加以检验。
【步骤二】未打磨的铝片浸入硫酸铜溶液中,一段时间内没有明显现象。
(2)比较步骤一、二,你能得出的结论是: ▲ 。
【步骤三】打磨过的铝片浸入硫酸铜溶液中,其操作、现象和结论见下表。
(3)试将“影响因素”选项前恰当的字母序号填入答题卡指定位置。
| 实验操作 | 使用现象 | 对比结论 |
| Ⅰ.一片用粗砂纸单向用力打磨3次,将其浸入硫酸铜溶液,片刻后用镊子取出。 | 现象一:粗砂纸打磨的在划痕处有少量气泡,附着少量疏松的紫红色固体。 | 现象一与现象二对比,说明 ① ▲ |
| 现象二:粗砂纸打磨的片刻内现象不明显。 | ||
| Ⅱ.一片用特细砂纸往复打磨数次,再将其浸入硫酸铜溶液,片刻后取出。 | 现象三:特细砂纸打磨的表面产生较多细小气泡,表面均匀附着紫红色固体。 | 现象三与现象一对比,说明 ② ▲ |
| 现象四:特细砂纸打磨的表面一段时间内没有明显现象。 | 现象四与现象三对比,说明 ③ ▲ |
★影响因素:
A.打磨时用力程度及均匀程度不同
B.选用砂纸颗粒粗细程度不同
C.由于摩擦生热又形成了新的氧化膜
(4)比较步骤三各实验操作中用砂纸打磨的作用是: ▲ 。
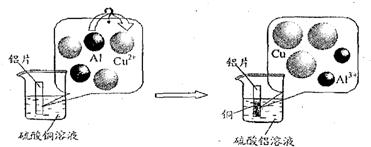
(5)请仔细观察下图:
试从微观粒子变化的角度分析该反应的实质是:
▲ 。
5.在日常生活中,我们发现切过咸菜的刀更容易生锈.而除锈用稀盐酸比稀硫酸快。为了
进一步验证上述现象,某校师生做了以下相关分组实验,请你根据自己平时课堂学习的体验一起参
与讨论并回答相关问题。
【步骤一】未打磨的铝片浸入氯化铜溶液中,迅速产生大量气泡和疏松的紫红色固体,并放热,片刻后溶液由蓝绿色变成无色。
(1)若要正视紫红色固体中是否含有氧化铜,可用 溶液(填一试剂)加以检验。
【步骤二】未打磨的铝片浸入硫酸铜溶液中,一段时间内没有明显现象。
(2)比较步骤一、二,你能得出的结论是: 。
【步骤三】打磨过的铝片浸入硫酸铜溶液中,其操作、现象和结论见下表。
(3)试将“影响因素”选项前恰当的字母序号填入答题卡指定位置。
| 实验操作 | 使用现象 | 对比结论 |
| Ⅰ.一片用粗砂纸单向用力打磨3次,将其浸入硫酸铜溶液,片刻后用镊子取出。 | 现象一:粗砂纸打磨的在划痕处有少量气泡,附着少量疏松的紫红色固体。 | 现象一与现象二对比,说明 ① |
| 现象二:粗砂纸打磨的片刻内现象不明显。 | ||
| Ⅱ.一片用特细砂纸往复打磨数次,再将其浸入硫酸铜溶液,片刻后取出。 | 现象三:特细砂纸打磨的表面产生较多细小气泡,表面均匀附着紫红色固体。 | 现象三与现象一对比,说明 ② |
| 现象四:特细砂纸打磨的表面一段时间内没有明显现象。 | 现象四与现象三对比,说明 ③ |
★影响因素:
A.打磨时用力程度及均匀程度不同
B.选用砂纸颗粒粗细程度不同
C.由于摩擦生热又形成了新的氧化膜
(4)比较步骤三各实验操作中用砂纸打磨的作用是: 。
(5)请仔细观察下图:
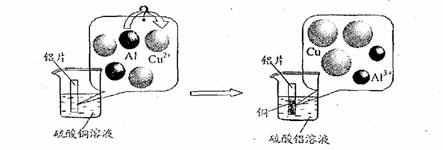
试从微观粒子变化的角度分析该反应的实质是 。



 (2012?惠安县质检)【探究实验1】碳酸氢钠溶液的酸碱性.
(2012?惠安县质检)【探究实验1】碳酸氢钠溶液的酸碱性.