题目内容
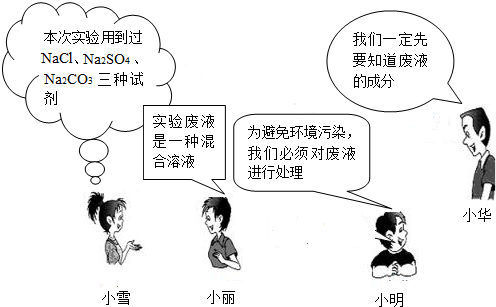
本次学生实验后,负责清洁实验室的小雪、小丽、小明和小华四位同学围绕如何处理“废液”展开了讨论:
在小组讨论的基础上,四位同学决定围绕废液的成分开展科学探究.

【提出问题】该废液的成分有哪些?
【猜想】
猜测一:废液为Na2SO4和NaCl组成的混合溶液;
猜测二:废液为Na2CO3和NaCl组成的混合溶液;
猜测三:废液为________组成的混合溶液;
猜测四:废液为Na2CO3、Na2SO4和NaCl组成的混合液.
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| ①用试管取一定量的废液,滴加过量的Ba(NO3)2溶液 | 有白色沉淀生成 | “猜测四”成立 |
| ②在①的反应液中滴加过量的. | __________________ | |
| ③将②的反应液静置,继续滴加适量的 溶液. | ___________________ |
(1)小丽在【实验探究】的第①步滴加“过量的Ba(NO3)2溶液”,“过量”的理由是________.
(2)小华在【实验探究】操作的基础上,只改变滴加试剂的顺序,也可以把它们鉴别出来.滴加这些试剂的顺序是:________、________、________.(标明用量)
解:【猜想】
实验中用过的三种物质都有可能成为废液的成分,它们形成的混合物共有四种组成,通过排列组合可知:除已经猜想出的三种情况外,还有一种是Na2SO4和Na2CO3.
【实验探究】
②在①的反应液中滴加过量的稀硝酸,白色沉淀部分溶解,且有气泡产生.在滴加硝酸钡的前提下,形成的一部分沉淀不溶于稀硝酸,说明废液中含有硫酸根离子,即含有Na2SO4;另一部分沉淀溶于稀硝酸,且有气泡产生,说明废液中含有碳酸根离子,即含有Na2CO3.
③由于硝酸钡溶液和稀硝酸都是过量的,因此能将废液中已经没有了硫酸根离子和碳酸根离子,它们已被全部除去,同时溶液中含有未反应的稀硝酸,在上述前提下滴加适量的硝酸银溶液,仍能产生白色沉淀,说明废液中含有氯离子,即含有NaCl.
因此猜想四成立.
【反思】
(1)小丽在【实验探究】的第①步滴加“过量的Ba(NO3)2溶液”,“过量”的理由是:使Na2SO4和Na2CO3全部沉淀,避免影响NaCl的检验.
(2)若第一步滴加过量的稀硝酸,观察到有气泡产生,说明废液中含有碳酸根离子,即含有碳酸钠.
第二步在第一步的反应液中滴加过量的硝酸钡溶液,观察到有白色沉淀生成.由于反应液中有过量的稀硝酸,在这一前提下,滴加硝酸钡溶液后仍能产生白色沉淀,说明该白色沉淀是硫酸钡,进而说明废液中含有硫酸根离子,即含有硫酸钠.
由于稀硝酸和硝酸钡溶液都是过量的,因此废液中已经没有了硫酸根离子和碳酸根离子,它们已被全部除去.在此前提下,第三步继续在第二步的反应液中滴加适量的硝酸银溶液后,仍能产生白色沉淀,说明该白色沉淀是氯化银,进而说明废液中含有氯离子,即含有氯化钠.
因此,小华在【实验探究】操作的基础上,只改变滴加试剂的顺序,也可以把它们鉴别出来.滴加这些试剂的顺序是:过量的稀硝酸、过量的Ba(NO3)2溶液、适量的AgNO3溶液.
故答案为:
猜测三:Na2SO4和Na2CO3
【实验探究】
②稀硝酸;白色沉淀部分溶解,且有气泡产生
③硝酸银;生成白色沉淀
【反思】
(1)使Na2SO4和Na2CO3全部沉淀,避免影响NaCl的检验.
(2)过量的稀硝酸、过量的Ba(NO3)2溶液、适量的AgNO3溶液.
分析:根据题设条件,按步分析,逻辑推理,层层推进,“对号入座”,得出结论.通过碳酸根离子、硫酸根离子和氯离子检验方法的操作和现象,抽丝剥茧,顺藤摸瓜,就可以顺理成章的得出本题的答案.
点评:本题主要考查酸碱盐的溶解性、酸碱盐和氧化物之间的反应规律、物质的组成等方面的知识,难度较大.解题时注意:(1)思维过程展示注意逻辑性;(2)发散性结论(几种可能组合)按序排列分析,防止遗漏或重复;(3)表述要清楚.
实验中用过的三种物质都有可能成为废液的成分,它们形成的混合物共有四种组成,通过排列组合可知:除已经猜想出的三种情况外,还有一种是Na2SO4和Na2CO3.
【实验探究】
②在①的反应液中滴加过量的稀硝酸,白色沉淀部分溶解,且有气泡产生.在滴加硝酸钡的前提下,形成的一部分沉淀不溶于稀硝酸,说明废液中含有硫酸根离子,即含有Na2SO4;另一部分沉淀溶于稀硝酸,且有气泡产生,说明废液中含有碳酸根离子,即含有Na2CO3.
③由于硝酸钡溶液和稀硝酸都是过量的,因此能将废液中已经没有了硫酸根离子和碳酸根离子,它们已被全部除去,同时溶液中含有未反应的稀硝酸,在上述前提下滴加适量的硝酸银溶液,仍能产生白色沉淀,说明废液中含有氯离子,即含有NaCl.
因此猜想四成立.
【反思】
(1)小丽在【实验探究】的第①步滴加“过量的Ba(NO3)2溶液”,“过量”的理由是:使Na2SO4和Na2CO3全部沉淀,避免影响NaCl的检验.
(2)若第一步滴加过量的稀硝酸,观察到有气泡产生,说明废液中含有碳酸根离子,即含有碳酸钠.
第二步在第一步的反应液中滴加过量的硝酸钡溶液,观察到有白色沉淀生成.由于反应液中有过量的稀硝酸,在这一前提下,滴加硝酸钡溶液后仍能产生白色沉淀,说明该白色沉淀是硫酸钡,进而说明废液中含有硫酸根离子,即含有硫酸钠.
由于稀硝酸和硝酸钡溶液都是过量的,因此废液中已经没有了硫酸根离子和碳酸根离子,它们已被全部除去.在此前提下,第三步继续在第二步的反应液中滴加适量的硝酸银溶液后,仍能产生白色沉淀,说明该白色沉淀是氯化银,进而说明废液中含有氯离子,即含有氯化钠.
因此,小华在【实验探究】操作的基础上,只改变滴加试剂的顺序,也可以把它们鉴别出来.滴加这些试剂的顺序是:过量的稀硝酸、过量的Ba(NO3)2溶液、适量的AgNO3溶液.
故答案为:
猜测三:Na2SO4和Na2CO3
【实验探究】
②稀硝酸;白色沉淀部分溶解,且有气泡产生
③硝酸银;生成白色沉淀
【反思】
(1)使Na2SO4和Na2CO3全部沉淀,避免影响NaCl的检验.
(2)过量的稀硝酸、过量的Ba(NO3)2溶液、适量的AgNO3溶液.
分析:根据题设条件,按步分析,逻辑推理,层层推进,“对号入座”,得出结论.通过碳酸根离子、硫酸根离子和氯离子检验方法的操作和现象,抽丝剥茧,顺藤摸瓜,就可以顺理成章的得出本题的答案.
点评:本题主要考查酸碱盐的溶解性、酸碱盐和氧化物之间的反应规律、物质的组成等方面的知识,难度较大.解题时注意:(1)思维过程展示注意逻辑性;(2)发散性结论(几种可能组合)按序排列分析,防止遗漏或重复;(3)表述要清楚.

练习册系列答案
相关题目
(2008?佛山)本次学生实验后,负责清洁实验室的小雪、小丽、小明和小华四位同学围绕如何处理“废液”展开了讨论:
在小组讨论的基础上,四位同学决定围绕废液的成分开展科学探究.

【提出问题】该废液的成分有哪些?
【猜想】
猜测一:废液为Na2SO4和NaCl组成的混合溶液;
猜测二:废液为Na2CO3和NaCl组成的混合溶液;
猜测三:废液为______组成的混合溶液;
猜测四:废液为Na2CO3、Na2SO4和NaCl组成的混合液.
【实验探究】
【反思】
(1)小丽在【实验探究】的第①步滴加“过量的Ba(NO3)2溶液”,“过量”的理由是______.
(2)小华在【实验探究】操作的基础上,只改变滴加试剂的顺序,也可以把它们鉴别出来.滴加这些试剂的顺序是:______、______、______.(标明用量)
在小组讨论的基础上,四位同学决定围绕废液的成分开展科学探究.

【提出问题】该废液的成分有哪些?
【猜想】
猜测一:废液为Na2SO4和NaCl组成的混合溶液;
猜测二:废液为Na2CO3和NaCl组成的混合溶液;
猜测三:废液为______组成的混合溶液;
猜测四:废液为Na2CO3、Na2SO4和NaCl组成的混合液.
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| ①用试管取一定量的废液,滴加过量的Ba(NO3)2溶液 | 有白色沉淀生成 | “猜测四”成立 |
| ②在①的反应液中滴加过量的. | __________________ | |
| ③将②的反应液静置,继续滴加适量的 溶液. | ___________________ |
(1)小丽在【实验探究】的第①步滴加“过量的Ba(NO3)2溶液”,“过量”的理由是______.
(2)小华在【实验探究】操作的基础上,只改变滴加试剂的顺序,也可以把它们鉴别出来.滴加这些试剂的顺序是:______、______、______.(标明用量)
26.(2008?佛山)本次学生实验后,负责清洁实验室的小雪、小丽、小明和小华四位同学围绕如何处理“废液”展开了讨论:
在小组讨论的基础上,四位同学决定围绕废液的成分开展科学探究.

【提出问题】该废液的成分有哪些?
【猜想】
猜测一:废液为Na2SO4和NaCl组成的混合溶液;
猜测二:废液为Na2CO3和NaCl组成的混合溶液;
猜测三:废液为______组成的混合溶液;
猜测四:废液为Na2CO3、Na2SO4和NaCl组成的混合液.
【实验探究】
【反思】
(1)小丽在【实验探究】的第①步滴加“过量的Ba(NO3)2溶液”,“过量”的理由是______.
(2)小华在【实验探究】操作的基础上,只改变滴加试剂的顺序,也可以把它们鉴别出来.滴加这些试剂的顺序是:______、______、______.(标明用量)
在小组讨论的基础上,四位同学决定围绕废液的成分开展科学探究.

【提出问题】该废液的成分有哪些?
【猜想】
猜测一:废液为Na2SO4和NaCl组成的混合溶液;
猜测二:废液为Na2CO3和NaCl组成的混合溶液;
猜测三:废液为______组成的混合溶液;
猜测四:废液为Na2CO3、Na2SO4和NaCl组成的混合液.
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| ①用试管取一定量的废液,滴加过量的Ba(NO3)2溶液 | 有白色沉淀生成 | “猜测四”成立 |
| ②在①的反应液中滴加过量的. | __________________ | |
| ③将②的反应液静置,继续滴加适量的 溶液. | ___________________ |
(1)小丽在【实验探究】的第①步滴加“过量的Ba(NO3)2溶液”,“过量”的理由是______.
(2)小华在【实验探究】操作的基础上,只改变滴加试剂的顺序,也可以把它们鉴别出来.滴加这些试剂的顺序是:______、______、______.(标明用量)