题目内容
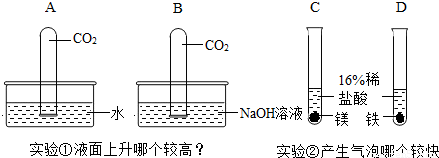
17、某校课外活动小组做了下列两组对比试验,请根据实验回答有关问题: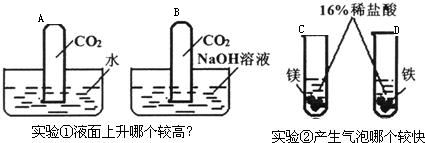
(1)实验①中试管内液面上升较高的是
(2)实验①中试管内液面上升较高的反应的化学方程式是:

(1)实验①中试管内液面上升较高的是
B
(填字母);实验②中产生气泡较快的是C
(填字母).(2)实验①中试管内液面上升较高的反应的化学方程式是:
CO2+2NaOH=Na2CO3+H2O
.分析:二氧化碳能溶于水用能与碱性溶液反应,液面上升的高度决定于反应掉的二氧化碳的体积.金属与同浓度的酸反应的剧烈程度决定于金属的活动性.
解答:解:二氧化能溶于水,也能与氢氧化钠反应,故试管B液面上升较高,方程式为CO2+2NaOH=Na2CO3+H2O;镁的金属活动性大于铁,与相同浓度的稀盐酸反应是镁反应速度快;
故答案为:(1)B;C;(2)CO2+2NaOH=Na2CO3+H2O
故答案为:(1)B;C;(2)CO2+2NaOH=Na2CO3+H2O
点评:金属活动性越强,与酸反应越剧烈.

练习册系列答案
相关题目