题目内容
完全燃烧3.2克某有机物,生成8.8克CO2,和7.2克水,关于有机物的组成的判断正确的是
- A.只含碳.氢两种元素,不含氧元素
- B.肯定含碳.氢两种元素,可能含氧
- C.含碳.氢两种元素,其质量比是11:9
- D.含碳.氢.氧三种元素,其质量比为8:1:16
A
分析:根据质量守恒定律分析,由题意“完全燃烧3.2克某有机物,生成8.8克CO2,和7.2克水”,则可推测参加反应的氧气的质量,二氧化碳与水中的氧元素、氢元素、碳元素的质量,从而推测答案.
解答:先根据反应前后元素的种类不变可以确定:该物质中一定含有碳、氢两种元素,可能含有氧元素;再根据反应前后元素的质量相等,来确定氧元素是否含有.
8.8g二氧化碳中碳元素的质量=8.8g×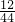 =2.4g,
=2.4g,
7.2g水中氢元素的质量=7.2g×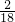 =0.8g,
=0.8g,
2.4g+0.8g=3.2g,与有机物的质量相等,故一定不含氧元素;碳、元素的质量比为2.4g:0.8g=3:1.
故选A.
点评:本题是运用化学中的基本思想质量守恒思想,学会处理此类计算的题目,从而培养了学生的创新思维能力.
分析:根据质量守恒定律分析,由题意“完全燃烧3.2克某有机物,生成8.8克CO2,和7.2克水”,则可推测参加反应的氧气的质量,二氧化碳与水中的氧元素、氢元素、碳元素的质量,从而推测答案.
解答:先根据反应前后元素的种类不变可以确定:该物质中一定含有碳、氢两种元素,可能含有氧元素;再根据反应前后元素的质量相等,来确定氧元素是否含有.
8.8g二氧化碳中碳元素的质量=8.8g×
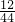 =2.4g,
=2.4g,7.2g水中氢元素的质量=7.2g×
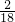 =0.8g,
=0.8g,2.4g+0.8g=3.2g,与有机物的质量相等,故一定不含氧元素;碳、元素的质量比为2.4g:0.8g=3:1.
故选A.
点评:本题是运用化学中的基本思想质量守恒思想,学会处理此类计算的题目,从而培养了学生的创新思维能力.

练习册系列答案
相关题目