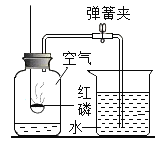
题目内容
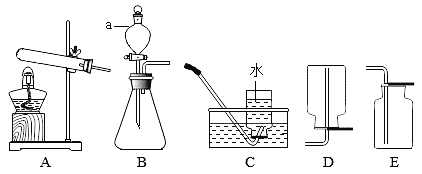
【题目】根据下图装置,结合所学化学知识,请回答下列问题:

(1)写出仪器①的名称:_______。
(2)选用B装置制取二氧化碳,写出该反应的化学方程式:________。
(3)查阅资料知,高铁酸钾(K2FeO4)固体可用于制取氧气,K2FeO4中Fe元素的化合价为__。
方案一: ![]() ;
;
方案二: ![]() 。
。
若用这两种方案制取等质量的氧气,所需高铁酸钾的质量__。(选填“ 相等”或“不相等”)
(4)已知:实验室用锌和稀盐酸反应制取的氢气中常含有氯化氢气体;纯净、干燥的氢气和镁在加热的条件下反应生成固体MgH2。若用锌、稀盐酸、镁粉为药品,选用上述装置连接制备固体MgH2,则装置的最佳连接顺序为____(选填字母标号)。
【答案】锥形瓶 ![]() +6 相等 BFCD
+6 相等 BFCD
【解析】
(1)据图可知仪器①的名称锥形瓶;
(2)装置B属于固、液常温型,适合用大理石(或石灰石)和稀盐酸反应制取二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)在K2FeO4中K显+1价,O显-2价,设Fe的价为x,则(+1)×2+x+(-2)×4=0,x=+6;在这两种方案中消耗K2FeO4和生成氧气的关系都是4K2FeO4~3O2,所以用这两种方案制取等质量的氧气,所需高铁酸钾的质量相等;
(4)实验室用锌和稀盐酸反应制取的氢气,属于固、液常温型,可用装置B作发生装置,氯化氢气体可用NaOH溶液除去,可用浓硫酸干燥,则装置的最佳连接顺序为:B、F、C、D。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含 MgSO4和 H2SO4的混合溶液,为确定混合溶液中镁的含量,取 4 份混合溶液各 100g,向每份混合溶液中加入一定质量的 4% NaOH溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH 溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
(1)实验 (填实验编号)中硫酸镁完全反应。
(2)计算 100g 混合溶液中含 MgSO4的质量(写出计算过程)
【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
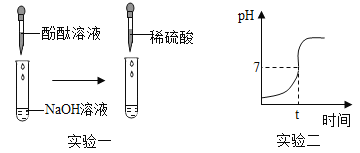
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | _____ | 氢氧化钠和硫酸发生了化学反应 |
(拓展延伸)在实验室,某同学将氢氧化钠溶液逐滴滴入稀硫酸和硫酸铜的混合溶液中至过量。加入氢氧化钠溶液的质量(横轴)与生成沉淀质量(纵轴)的关系如图所示:
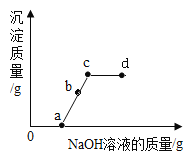
(1)图中a→c线段对应的现象是_____;
(2)图中b点处溶液中的溶质是_____;
(3)实验结束后(图中d点处)的溶液不能直接向外排放的原因是_____。