题目内容
【题目】水是一种重要的物质,在日常生活生产和实验室中有着不可替代的作用。回答下列问题:
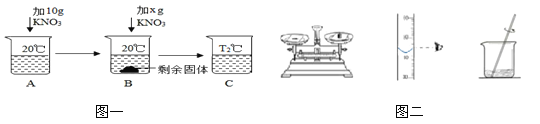
(1)如图一所示,向50g水中加KNO3固体(已知20℃时KNO3的溶解度为31.6g/100g水),当B中KNO3加到 g时,B恰好饱和;图示中B到C的操作可以是 。
(2)若按照图二所示的操作配制10%的食盐溶液,则配制的食盐溶液的浓度会 10%。(填“大于”、“小于”或“等于”)
(3)高铁酸钾(K2FeO4)是一种新型高效的水处理剂,高铁酸钾受热时会发生反应如下:
4K2FeO4 ![]() 2X + 4K2O + 3O2↑,生成物X的化学式是 ,K2FeO4→O2中氧元素由 态变成 态。
2X + 4K2O + 3O2↑,生成物X的化学式是 ,K2FeO4→O2中氧元素由 态变成 态。
(4)海水通常含泥沙和可溶性杂质,净化海水需采取的措施是 (填编号)。
A.沉降 B.过滤 C.吸附 D.蒸馏
【答案】(1)5.8 升温或过滤(2)大于
(3)Fe2O3 化合态 游离态(4)ABCD
【解析】
试题分析:(1)已知20℃时KNO3的溶解度为31.6g/100g水,现在只有50g水,达到饱和状态最多溶解的质量为31.6g÷2=15.8g,故当B中加入KNO3的质量=15.8g=10g=5.8g 恰好饱和;通过图示可知,溶液B为饱和溶液,因为溶液中由未溶解的溶质,要使未溶解的全部溶解,根据硝酸钾的溶解度随温度的升高而增大,故图示中B到C的操作可以是升温或过滤
(2)量筒读数时,视线应与刻度线及凹液面的最低处保持水平,若按照图二所示的操作,量取水的体积偏小,故配制的食盐溶液的浓度会大于10%
(3)根据质量守恒定律的微观解释:在化学反应前后,原子的种类、数目都不变,结合化学反应:4K2FeO4 △ 2X + 4K2O + 3O2↑,可以推出X化学式为 Fe2O3;K2FeO4→O2中氧元素由化合态变成游离态
(4)水净化的步骤有:沉降、过滤、吸附、蒸馏,故净化海水需采取的措施选ABCD

【题目】在学完氧气的性质后,某校课外小组同学对铁丝在氧气中燃烧的实验进行了更深入的探究。
说明:下述实验中所用的8根铁丝均从1根长铁丝上截取,并且长度相同。
探究1:铁丝燃烧是否需要纯氧?
实验内容:取5根铁丝,分别在体积分数为90%、70%、65%、60%、55%的氧气中进行实验。
实验记录如下:
V(O2)% | 实验现象 |
90% | 燃烧剧烈,燃烧时间长,实验成功 |
70% | 燃烧比90%的弱,燃烧时间短,实验成功 |
65% | 燃烧比70%的弱,燃烧时间比70%的短,实验成功 |
60% | 燃烧比65%的弱,燃烧时间更短,实验成功 |
55% | 难以燃烧,只是发红 |
探究2:铁丝绕成螺旋状的原因是什么?
关于铁丝绕成螺旋状的原因,甲同学认为是为了增大与氧气的接触面积,乙同学认为是聚热效果好,能使未燃的铁丝更好的预热。在老师的指导下,小组同学进行了实验,实验操作及现象如下表所示,实验中3个集气瓶均盛有等量的水和体积分数相同的氧气。

回答下述问题:
(1)铁丝在氧气中燃烧的化学反应方程式为 。
(2)通过探究1实验,丙同学得出结论:铁丝在氧气中燃烧,所需氧气的最低体积分数为60%,你对他得出的结论的看法是 。
(3)探究2实验中,3根铁丝均要完全伸入集气瓶中的原因是 。
(4)根据探究2实验,你认为 (填“甲”或“乙”)同学说法合理,其理由是 。
(5)探究1实验用排水法收集氧气时,每瓶都要留存30mL水,以防止熔融物炸裂瓶底。实验中收集体积分数为90%的氧气时,设应向空集气瓶中加入水的体积为x,请列出能求解x的计算式 (空集气瓶容积为310mL,不考虑橡皮塞所占体积)。