题目内容
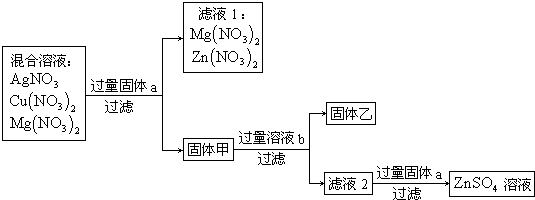
现有硝酸银、硝酸铜和硝酸镁三种物质组成的混合溶液,进行下列实验:

根据实验推断:
(1)固体甲是______;
(2)滤液2中的溶质是______(写化学式);
(3)滤液2跟固体a反应的化学方程式是______.
解:(1)由于镁、锌、铜、银的金属活动性强弱为镁>锌>铜>银,向硝酸镁、硝酸铜、硝酸银溶液中加入过量的锌,锌可置换出硝酸铜、硝酸银中的铜和银,所以固体甲为铜、银、锌的混合物;
(2)锌可和酸反应,铜和银不与酸反应,加入过量的b(稀硫酸),过滤,得到固体铜和银,滤液2的溶质为硫酸锌、硫酸;
(3)滤液2中加入过量锌,过滤,得到硫酸锌溶液.
故答案为:
(1)Cu、Ag、Zn的混合物;
(2)ZnSO4、H2SO4;
(3)Zn+H2SO4=ZnSO4+H2↑.
分析:(1)根据四种金属的活动性强弱关系:镁>锌>铜>银,判断向混合溶液中加入一定量锌粒可能发生的反应;
(2)根据铜、银不和硫酸反应,锌可置换出酸中的氢,可知b为稀硫酸;
(3)加入锌,除去过量的稀硫酸.
点评:金属放入盐的混合溶液,金属按盐中金属活动性由弱到强的顺序和盐先后反应,即先与活动性最弱的金属的盐反应.
(2)锌可和酸反应,铜和银不与酸反应,加入过量的b(稀硫酸),过滤,得到固体铜和银,滤液2的溶质为硫酸锌、硫酸;
(3)滤液2中加入过量锌,过滤,得到硫酸锌溶液.
故答案为:
(1)Cu、Ag、Zn的混合物;
(2)ZnSO4、H2SO4;
(3)Zn+H2SO4=ZnSO4+H2↑.
分析:(1)根据四种金属的活动性强弱关系:镁>锌>铜>银,判断向混合溶液中加入一定量锌粒可能发生的反应;
(2)根据铜、银不和硫酸反应,锌可置换出酸中的氢,可知b为稀硫酸;
(3)加入锌,除去过量的稀硫酸.
点评:金属放入盐的混合溶液,金属按盐中金属活动性由弱到强的顺序和盐先后反应,即先与活动性最弱的金属的盐反应.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目