题目内容
【题目】某工厂废液中含有氯化铜和氯化亚铁,某课外小组要将废液进行处理并得到铜和氧化铁两种产品,过程如图所示。
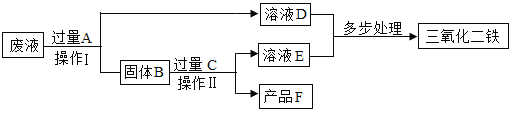
(1)加入A物质发生的化学反应方程式为______________________________;
(2)操作Ⅰ和Ⅱ的名称是________,其中除用到烧杯、漏斗和铁架台外,还需要的玻璃仪器是__________;
(3)检验C过量的方法是____________________________;
(4)经过处理后,氧化铁中铁元素________(选填“等于”“小于”或“大于”)原废液中氯化亚铁中铁元素质量。
【答案】 Fe+CuCl2===FeCl2+Cu 过滤 玻璃棒 加入铁粉有气泡生成 大于
【解析】(1)要得到铜和氧化铁这两种产品,则需要加入铁将氯化铜中的铜置换出来,所以A是铁,铁能与氯化铜反应生成氯化亚铁和铜,化学方程式为:Fe+CuCl2=FeCl2+Cu;(2)经过操作I得到了固体和溶液,所以操作I是分离不溶性固体和液体的方法,为过滤操作,根据除用到烧杯、漏斗和铁架台外,还需要的玻璃仪器是玻璃棒;(3)要将过量的铁除去,需要加入稀盐酸,故C为稀盐酸,使铁与盐酸反应生成氯化亚铁和氢气,若要检验盐酸过量,可以取过滤得到的溶液E中加入锌粉,观察到有气泡产生,故填:取少量溶液E于试管中,加入少量锌粒,若有气泡产生,则C过量;(4)因为“操作Ⅱ,加入过量的铁”经过处理后,氧化铁中铁元素大于原废液中氯化亚铁中铁元素质量。

练习册系列答案
相关题目


