题目内容
3.6克有机物在空气中充分燃烧后化成4.4克CO2和3.6克水,此刻有机物中
- A.一定含有C、H、O三种元素
- B.一定含有C、H元素,可能含有O元素
- C.一定含有C、H元素,不含O元素
- D.只含有C、H元素,不含O元素
A
分析:根据质量守恒定律解答本题.根据生成二氧化碳的质量和二氧化碳中碳元素的质量分数,计算出该有机物中含有C的质量,同理,根据生成水的质量和H2O中氢元素的质量分数,计算出该有机物中含有H的质量,再根据质量守恒定律,反应前该有机物质量减去C、H的质量,就是其含有O的质量,据此即可判断该有机物中含有的元素.
解答:根据质量守恒定律,反应后生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,生成的水中氢元素的质量就是有机物中氢元素的质量.
该有机物中含有C的质量为:4.4g× =1.2g;
=1.2g;
该有机物中含有H的质量为:3.6g×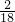 =0.4g;
=0.4g;
则3.6g有机物中C、H元素质量和=1.2g+0.4g=1.6g<3.6g,因此,有机物一定含C、H、O三种元素;
故选A.
点评:本题考查燃烧法确定有机物的化学式,学生应能根据元素守恒、质量守恒的思维来分析解答问题,注意守恒思想在化学式推断中的重要作用.
分析:根据质量守恒定律解答本题.根据生成二氧化碳的质量和二氧化碳中碳元素的质量分数,计算出该有机物中含有C的质量,同理,根据生成水的质量和H2O中氢元素的质量分数,计算出该有机物中含有H的质量,再根据质量守恒定律,反应前该有机物质量减去C、H的质量,就是其含有O的质量,据此即可判断该有机物中含有的元素.
解答:根据质量守恒定律,反应后生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,生成的水中氢元素的质量就是有机物中氢元素的质量.
该有机物中含有C的质量为:4.4g×
 =1.2g;
=1.2g;该有机物中含有H的质量为:3.6g×
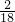 =0.4g;
=0.4g;则3.6g有机物中C、H元素质量和=1.2g+0.4g=1.6g<3.6g,因此,有机物一定含C、H、O三种元素;
故选A.
点评:本题考查燃烧法确定有机物的化学式,学生应能根据元素守恒、质量守恒的思维来分析解答问题,注意守恒思想在化学式推断中的重要作用.

练习册系列答案
相关题目
在一个密闭容器内有A、B、C、D,四种物质在一定条件下反应,一段时间后,测得反应前后各物质的质量如下:
| 物质 | A | B | C | D |
| 反应前的质量(g) | 11 | 18 | 10 | 6 |
| 反应后的质量(g) | 33 | 4 | X | 6 |
- A.此反应为化合反应
- B.D一定为催化剂
- C.X值为8
- D.X值为2,D一定是未参加反应的物质
区分日常生活中的下列各组物质,其中两种方法都正确的是
| 选项 | 需区分的物质 | 实验方法 |
| A | 食盐和白糖 | ①稀盐酸 ②加水溶解 |
| B | 合成纤维和天然纤维 | ①点燃闻气味 ②观察色泽 |
| C | 白酒和白醋 | ①闻气味 ②加石灰石 |
| D | 矿泉水和蒸馏水 | ①蒸干 ②尝味道 |
- A.A
- B.B
- C.C
- D.D