题目内容
在6月5日“世界环境日”活动中,某兴趣小组对生产及生活污水进行了探究.
(1)第一小组同学在学校附近的家化工厂调查,发现该厂在生产过程中用到硫酸.
[猜想]该工厂排放的废水呈酸性.
[设计实验]
[建议与反思]为防止造成水污染,同学们联合向厂家建议,应将废水治理达标后再排放,你认为治理该酸性废水时适宜加入的试剂是______(任答一种),此时废水的pH将______(填“升高”、“不变”或“降低”).
[进一步探究]取一定体积从该厂排出的含硫酸的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性.若改用跟氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,所得溶液的pH______7(填“<”、“>”、“=”).
(2)另一小组同学在城市的一条小河中取了水样,发现水样变浑浊,便在浑浊的水中加入适量的明矾,通过搅拌、静置后,发现水变得澄清了.
[查阅资料]明矾[化学式:KAl(SO4)2?12H2O]是一种常见的净水剂,它在水中解离出的离子主要有K+、Al3+、S
.
[提出问题]明矾中哪一种离子有净水作用?
[设计实验]小敏进行了如下实验,请填写表中空白:
[完善方案]小敏的实验方案不完善,需要对方进行补充.请你将补充方案中的实验目的和所使用的试剂填入下表
[反思]研究表明:河水部分水体污染是由于水中氮、磷含量过高导致水质恶化.请你用所学习的化学知识进行分析:水体中氮、磷含量过高与人们在生产、生活中的哪些行为活动有关?(要求至少答出两点)
(1)第一小组同学在学校附近的家化工厂调查,发现该厂在生产过程中用到硫酸.
[猜想]该工厂排放的废水呈酸性.
[设计实验]
| 实验操作 | 实验现象 | 实验结论 |
| ______ | ______ | 该废水呈酸性 |
[进一步探究]取一定体积从该厂排出的含硫酸的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性.若改用跟氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,所得溶液的pH______7(填“<”、“>”、“=”).
(2)另一小组同学在城市的一条小河中取了水样,发现水样变浑浊,便在浑浊的水中加入适量的明矾,通过搅拌、静置后,发现水变得澄清了.
[查阅资料]明矾[化学式:KAl(SO4)2?12H2O]是一种常见的净水剂,它在水中解离出的离子主要有K+、Al3+、S
| O | 2-4 |
[提出问题]明矾中哪一种离子有净水作用?
[设计实验]小敏进行了如下实验,请填写表中空白:
| 实验操作 | 实验现象 | 实验结论 |
| 在一杯浑浊的水中加入少量KCl,静置 | 烧杯中的水仍然浑浊 | K+和Cl+都没有净水作用 |
| 在一杯浑浊的水中加入少量Al2(SO4)3,静置 | 烧杯中的水变澄清 | ______ |
| 实验目的 | 使用的试剂 |
| Al3+是否有净水作用 | ______ |
| ______ | ______ |
(1)[设计实验]
用酸碱指示剂可判断废水的酸碱性,由猜想该工厂排放的废水呈酸性,所以可用石蕊试液加以鉴定;
故答案为:
(其他答案合理也可)
[建议与反思]
硫酸可与金属、碱、某些金属氧化物、某些盐反应,反应后酸性降低,pH值升高;
故答案为:生石灰(合理均可);升高;
[进一步探究]
2NaOH+H2SO4═Na2SO4+2H2O 2KOH+H2SO4═K2SO4+2H2O
80 98 112 98
由方程式中物质之间的质量比可以看出,等质量的硫酸消耗的氢氧化钾的质量多;所以取一定体积从该厂排出的含硫酸的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性.若改用跟氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,所得溶液的pH<7;
故答案为:<;
(2)[设计实验]
明矾在水中解离出的离子主要有K+、Al3+、S
;加硫酸铝后水变澄清,说明Al3+、SO42-中的一种或两种有净水作用;
故答案为:Al3+、SO42-中的一种或两种有净水作用;
[完善方案]
小红的实验方案之所以不完善,是因为还不能证明到底是Al3+还是SO42-具有净水作用,还需要补充实验,要证明Al3+是否具有净水作用,可选用AlCl3,要证明SO42-是否具有净水作用,可选用K2SO4;
故答案为:
[反思]
工业废水的任意排放,农业上化肥、农药的大量使用,生活中含磷洗涤剂的使用等都会造成水体中氮、磷含量过高;
故答案为:农业上化肥、农药的不合理使用,生活中含磷洗涤剂的使用(合理均可)
用酸碱指示剂可判断废水的酸碱性,由猜想该工厂排放的废水呈酸性,所以可用石蕊试液加以鉴定;
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取少量的该废水,滴加紫色的石蕊溶液 | 废水变红 | 该废水显酸性 |
[建议与反思]
硫酸可与金属、碱、某些金属氧化物、某些盐反应,反应后酸性降低,pH值升高;
故答案为:生石灰(合理均可);升高;
[进一步探究]
2NaOH+H2SO4═Na2SO4+2H2O 2KOH+H2SO4═K2SO4+2H2O
80 98 112 98
由方程式中物质之间的质量比可以看出,等质量的硫酸消耗的氢氧化钾的质量多;所以取一定体积从该厂排出的含硫酸的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性.若改用跟氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,所得溶液的pH<7;
故答案为:<;
(2)[设计实验]
明矾在水中解离出的离子主要有K+、Al3+、S
| O | 2-4 |
故答案为:Al3+、SO42-中的一种或两种有净水作用;
[完善方案]
小红的实验方案之所以不完善,是因为还不能证明到底是Al3+还是SO42-具有净水作用,还需要补充实验,要证明Al3+是否具有净水作用,可选用AlCl3,要证明SO42-是否具有净水作用,可选用K2SO4;
故答案为:
| 实验目的 | 使用的试剂 |
| Al3+是否有净水作用 | AlCl3 |
| SO42-是否有净水作用 | K2SO4 |
工业废水的任意排放,农业上化肥、农药的大量使用,生活中含磷洗涤剂的使用等都会造成水体中氮、磷含量过高;
故答案为:农业上化肥、农药的不合理使用,生活中含磷洗涤剂的使用(合理均可)

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
去年6月5日世界环境日的主题为:“水--20亿人生命之所系”.请你参与下列问题的讨论.

(1)净水过程中,利用活性炭的________作用同时除去臭味和一些溶解的杂质.
(2)去年9月份,南京城北污水处理系统一期工程如期完成.届时湖南路、中山路、新模范马路及下关部分地区的水环境将首先得到改善.为了检测废水是否达到排放标准,请你设计以下实验:
在实验室过滤除去废水中的固体杂质,所需的玻璃仪器有________、________、________.
(3)三峡工程(二期)已于2003年6月1日开始蓄水.为防止三峡库区水被污染,应采取的措施是(填序号)________.
①清理蓄水库库底固体废物 ②防治船舶污染 ③整治相关河流污染 ④治理库区和上游工业污染区
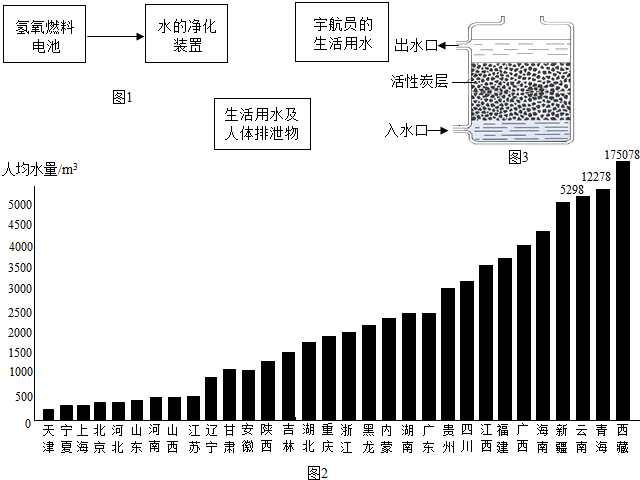
(4)载人飞船必须建立水的循环体系,以保证宇航员的生活用水,并减少飞船的携水量.请将图1各项用箭头连接成水的循环体系.(注:氢氧燃料电池反应产生电能,同时生成水)
(5)根据下面两张图表提供的有关数据,北京水资源紧缺指标属于________范围.所以,我们每个北京市民都必须爱护水资源;一方面要防止水体污染,另一方面要________用水.图2是我国各地区(香港、澳门、台湾暂未列入)人均水量
图3是市场上出售的一种活性炭净水器示意图.这种净水器可以除去水中的难溶________
图表:水资源紧缺指标
| 紧缺性 | 轻度缺水 | 中度缺水 | 重度缺水 | 极度缺水 |
| 人均水量m3/年 | 1700~3000 | 1000~1700 | 500~1000 | <500 |
(7)硬水和软水的本质区别是________含量的多少不同.家庭生活中可以用________检验某水样是硬水还是软水.

 15、去年6月5日世界环境日的主题为:“水--20亿人生命之所系”.请你参与下列问题的讨论.
15、去年6月5日世界环境日的主题为:“水--20亿人生命之所系”.请你参与下列问题的讨论.