题目内容
(1)磁铁矿的主要成分是:______;(填化学式)
(2)写出CO与Fe2O3在高温条件下反应的化学方程式:______;
(3)高炉炼铁得到的主要产品是______;(填序号) A.纯铁 B.生铁 C.钢
(4)工业上火法炼铜的一个主要反应是Cu2S+O2 2Cu+SO2,Cu2S中铜元素的质量分数为______.用500吨含Cu2S 80%的铜矿石,理论上可以炼出______吨铜.
2Cu+SO2,Cu2S中铜元素的质量分数为______.用500吨含Cu2S 80%的铜矿石,理论上可以炼出______吨铜.
解:(1)磁铁矿的主要成分是:四氧化三铁,其化学式为Fe3O4;
(2)由题意可知反应物、反应条件、生成物,故写出CO与Fe2O3在高温条件下反应的化学方程式:Fe2O3+3CO 2Fe+3CO2;
2Fe+3CO2;
(3)高炉炼铁得到的主要产品是铁的混合物-------生铁B;
(4)Cu2S中铜元素的质量分数=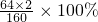 =80%;则500吨含Cu2S 80%的铜矿石中含铜元素质量=500t×80%×80%=320t.
=80%;则500吨含Cu2S 80%的铜矿石中含铜元素质量=500t×80%×80%=320t.
故答案为:(1)Fe3O4;(2)Fe2O3+3CO 2Fe+3CO2;(3)B;(4)80%;320.
2Fe+3CO2;(3)B;(4)80%;320.
分析:(1)磁铁矿的主要成分是:四氧化三铁;
(2)由题意可知:反应物为一氧化碳与氧化铁,反应条件为高温,生成物为铁与二氧化碳;
(3)高炉炼铁得到的主要产品是铁的混合物-----生铁(含有碳元素);
(4)根据化学式Cu2S计算铜元素的质量分数,并计算一定质量的Cu2S物质中铜元素的质量,物质中某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)由题意可知反应物、反应条件、生成物,故写出CO与Fe2O3在高温条件下反应的化学方程式:Fe2O3+3CO
 2Fe+3CO2;
2Fe+3CO2;(3)高炉炼铁得到的主要产品是铁的混合物-------生铁B;
(4)Cu2S中铜元素的质量分数=
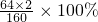 =80%;则500吨含Cu2S 80%的铜矿石中含铜元素质量=500t×80%×80%=320t.
=80%;则500吨含Cu2S 80%的铜矿石中含铜元素质量=500t×80%×80%=320t.故答案为:(1)Fe3O4;(2)Fe2O3+3CO
 2Fe+3CO2;(3)B;(4)80%;320.
2Fe+3CO2;(3)B;(4)80%;320.分析:(1)磁铁矿的主要成分是:四氧化三铁;
(2)由题意可知:反应物为一氧化碳与氧化铁,反应条件为高温,生成物为铁与二氧化碳;
(3)高炉炼铁得到的主要产品是铁的混合物-----生铁(含有碳元素);
(4)根据化学式Cu2S计算铜元素的质量分数,并计算一定质量的Cu2S物质中铜元素的质量,物质中某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
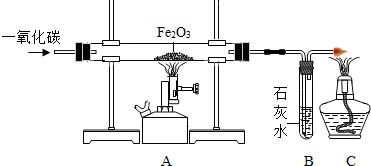
 (2013?荔城区模拟)钢铁是非常重要的金属材料.我市马坑铁矿是华东区最大的磁铁矿(主要成分为Fe3O4),总储量达到4.34亿吨.实验室可用如图装置模拟工业炼铁.
(2013?荔城区模拟)钢铁是非常重要的金属材料.我市马坑铁矿是华东区最大的磁铁矿(主要成分为Fe3O4),总储量达到4.34亿吨.实验室可用如图装置模拟工业炼铁.