题目内容
 (2008?随州)将稀盐酸逐滴加人到碳酸钠溶液中,先发生反应:Na2CO3+HCI═NaHCO3+NaCl,再发生反应:NaHCO3+HCl═NaCl+CO2↑+H2O.现取22g含有少量氯化钠的纯碱样品于烧杯中,加适量水将其溶解,然后逐滴加入适量稀盐酸,并不断振荡.测得滴加盐酸量与生成二氧化碳质量的关系如图所示.
(2008?随州)将稀盐酸逐滴加人到碳酸钠溶液中,先发生反应:Na2CO3+HCI═NaHCO3+NaCl,再发生反应:NaHCO3+HCl═NaCl+CO2↑+H2O.现取22g含有少量氯化钠的纯碱样品于烧杯中,加适量水将其溶解,然后逐滴加入适量稀盐酸,并不断振荡.测得滴加盐酸量与生成二氧化碳质量的关系如图所示.试计算:
(1)盐酸溶液的质量分数.
(2)22g样品中含氯化钠的质量.
分析:(1)由题给信息和图示可知:滴入盐酸质量超过73g时,开始放出CO2,当加人盐酸质量为146g时,反应完全,则生成8.8gCO2所需盐酸质量为73g,然后根据化学方程式计算出73g盐酸中氯化氢的质量,从而计算出盐酸的质量分数;
(2)根据73g盐酸的质量和质量分数计算出溶质的质量,然后根据化学方程式计算出样品中碳酸钠的质量,从而计算出氯化钠的质量.
(2)根据73g盐酸的质量和质量分数计算出溶质的质量,然后根据化学方程式计算出样品中碳酸钠的质量,从而计算出氯化钠的质量.
解答:解:(1)由题给信息和图示可知:滴入盐酸质量超过73g时,开始放出CO2,当加人盐酸质量为146g时,反应完全,则生成8.8gCO2所需盐酸质量为73g.
设生成8.8g CO2所需氯化氢的质量为x,
NaHCO3+HCl═NaCl+CO2↑+H2O
36.5 44
x 8.8g
=
,解得x=7.3g,
则盐酸中溶质质量分数为:
×100%=lO%;
(2)设22g样品中Na2CO3的质量为y,
Na2CO3+HCl═NaHCO3+NaCl
106 36.5
y 73g×10%
=
,解得y=21.2g,
则22g样品中NaCl的质量为:22g-21.2g=0.8g.
答:(1)盐酸中溶质质量分数为l0%;(2)22g样品中含NaCl的质量为0.8g.
设生成8.8g CO2所需氯化氢的质量为x,
NaHCO3+HCl═NaCl+CO2↑+H2O
36.5 44
x 8.8g
| 36.5 |
| 44 |
| x |
| 8.8g |
则盐酸中溶质质量分数为:
| 7.3g |
| 73g |
(2)设22g样品中Na2CO3的质量为y,
Na2CO3+HCl═NaHCO3+NaCl
106 36.5
y 73g×10%
| 106 |
| 36.5 |
| y |
| 73g×10% |
则22g样品中NaCl的质量为:22g-21.2g=0.8g.
答:(1)盐酸中溶质质量分数为l0%;(2)22g样品中含NaCl的质量为0.8g.
点评:难度较大,考查了利用图形结合化学方程式对问题进行分析和计算的能力.

练习册系列答案
相关题目
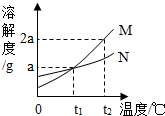 (2008?随州)如图所示是M、N两种物质的溶解度曲线,在t2℃时往盛有50g水的烧杯中先后加入a g M和a g N(两物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降到t1℃.下列说法错误的是( )
(2008?随州)如图所示是M、N两种物质的溶解度曲线,在t2℃时往盛有50g水的烧杯中先后加入a g M和a g N(两物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降到t1℃.下列说法错误的是( )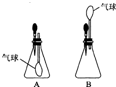 (2008?随州)小刚设计如图A、B所示装置进行下列趣味实验:
(2008?随州)小刚设计如图A、B所示装置进行下列趣味实验: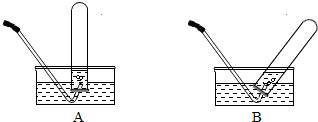 (2008?随州)马坪中学化学兴趣小组对“双氧水溶液与二氧化锰制氧气“进行了下列实验与探究:
(2008?随州)马坪中学化学兴趣小组对“双氧水溶液与二氧化锰制氧气“进行了下列实验与探究: