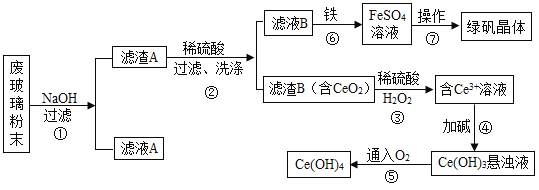
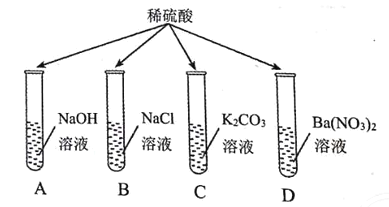
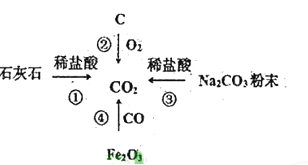
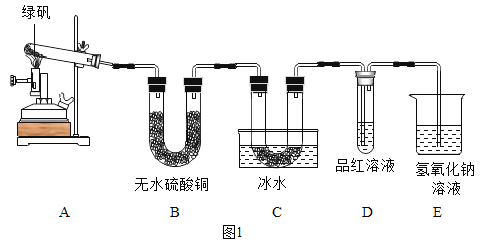
题目内容
【题目】甲、乙、丙为初中常见物质,其转化关系如下图(“→”表示由一种物质转化成另一种物质,反应条件、部分反应物和生成物已略去)。
![]()
(1)若甲,乙、丙均含有同一种元素,甲为单质,乙、丙含有相同的两种元素,写出甲物质的用途:_____,则丙可能是_____。
(2)若甲、乙、丙均为含有钙元素的化合物,甲与水反应生成乙并放出大量的热,则甲→乙的化学方程式为_____,丙可能是_____(写一种)。
【答案】做导线(合理均可) CuSO4(合理均可) CaO+H2O═Ca(OH)2 CaCl2或CaCO3或CaSO4(填一个即可)
【解析】
(1)根据常见物质的性质和反应现象或条件以及题目中给出的要求进行分析推断,注意关键字眼,比如甲是单质,甲乙丙均含同一元素而乙、丙含两种相同元素,找出符合条件的物质即可;
(2)甲、乙、丙若都有钙元素,与水反应放热可知甲是氧化钙,在根据后续反应推断即可。
(1)根据题意甲必须是单质且甲乙丙含有同一种元素,乙、丙还必须含两种相同的元素,所以甲可以是Cu,铜和氧气在加热的条件下生成CuO,所以乙可以是CuO,CuO和硫酸反应生成硫酸铜,所以丙可以是CuSO4,即甲、乙丙都含有铜元素,且满足了甲是单质,乙、丙都含有铜、氧元素(答案不唯一,只要满足题目给出的条件,合理均可)。铜可以用来做导线,故填:做导线;CuSO4(合理均可)
(2)甲、乙、丙均为含有钙元素的化合物,甲与水反应生成乙并放出大量的热,则甲是氧化钙,俗称生石灰,与水反应生成的乙是氢氧化钙,丙可能是氢氧化钙生成的氯化钙、碳酸钙、硫酸钙写其中一种即可;故填:CaO+H2O═Ca(OH)2;CaCl2或CaCO3或CaSO4(填一个即可)。

【题目】(1)按要求写出对应的化学符号(“![]() ”表示氧原子)。
”表示氧原子)。
微粒 |
|
|
|
化学符号 | _____ | _____ | _____ |
(2)模型是联系宏观与微观的桥梁。如图是氧原子的结构示意图。

①x的数值为 _____。
②“8”指的是 _____。
③氧原子在化学反应中易得到2个电子,形成_____(填离子符号)。