题目内容
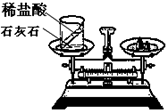 (1)如图的装置中,在反应前天平平衡.当稀盐酸和石灰石混合后,完全反应后发现天平不再保持平衡,指针向
(1)如图的装置中,在反应前天平平衡.当稀盐酸和石灰石混合后,完全反应后发现天平不再保持平衡,指针向(2)若反应变为“湿法炼铜”.写出“湿法炼铜”的化学方程式:
(3)若用“湿法炼铜”制得铜16g,参加反应的铁的质量
分析:(1)依据该反应能够生成二氧化碳的有关知识结合化学方程式的基本计算解决;
(2)依据湿法炼铜的原理以及反应的特点分析解答;
(3)依据化学方程式的基本计算分析解答;
(2)依据湿法炼铜的原理以及反应的特点分析解答;
(3)依据化学方程式的基本计算分析解答;
解答:解:(1)由于稀盐酸和石灰石混合后能够反应生成二氧化碳气体,而该气体会不断的散失到空气中,导致左侧物质的总质量减小,所以指针会向右偏转,
该反应的方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O,5.0克的石灰石与10.0克稀盐酸完全反应后,最终称得左盘质量为14.78克,则减小值即为生成二氧化碳的质量,即:5g+10g-14.78g=0.22g 设碳酸钙的质量是x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 0.22g
=
x=0.5g
则石灰石含碳酸钙的质量分数为:
×100%=10%
(2)湿法炼铜的原理是铁和硫酸铜的反应,其方程式为Fe+CuSO4=FeSO4+Cu;由于该反应过程中不会有气体生成,所以可以用来验证质量守恒定律;
(3)设要制取16g铜需要铁的质量是x,硫酸铜的质量是y
Fe+CuSO4=FeSO4+Cu
56 160 64
x y 16g
=
=
x=14g y=40g
该硫酸铜溶液中硫酸铜的质量分数为
×100%=16%
故答案为:(1)右;CaCO3+2HCl═CaCl2+CO2↑+H2O;10%;(2)Fe+CuSO4=FeSO4+Cu;能;(3)14;16;
该反应的方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O,5.0克的石灰石与10.0克稀盐酸完全反应后,最终称得左盘质量为14.78克,则减小值即为生成二氧化碳的质量,即:5g+10g-14.78g=0.22g 设碳酸钙的质量是x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 0.22g
| 100 |
| x |
| 44 |
| 0.22g |
x=0.5g
则石灰石含碳酸钙的质量分数为:
| 0.5g |
| 5g |
(2)湿法炼铜的原理是铁和硫酸铜的反应,其方程式为Fe+CuSO4=FeSO4+Cu;由于该反应过程中不会有气体生成,所以可以用来验证质量守恒定律;
(3)设要制取16g铜需要铁的质量是x,硫酸铜的质量是y
Fe+CuSO4=FeSO4+Cu
56 160 64
x y 16g
| 56 |
| x |
| 160 |
| y |
| 64 |
| 16g |
x=14g y=40g
该硫酸铜溶液中硫酸铜的质量分数为
| 40g |
| 250g |
故答案为:(1)右;CaCO3+2HCl═CaCl2+CO2↑+H2O;10%;(2)Fe+CuSO4=FeSO4+Cu;能;(3)14;16;
点评:对于质量守恒定律的理解要注意时所用的物质的质量包括气体固体和液体,而气体容易被忽略,所以在设计验证质量守恒的实验时要考虑实验在密闭容器中进行.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
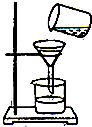 实验室常用如图所示的方法进行净水.
实验室常用如图所示的方法进行净水.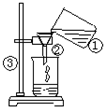 实验室常用如图所示的方法进行净水.
实验室常用如图所示的方法进行净水.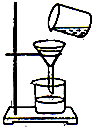 实验室常用如图所示的方法进行净水.
实验室常用如图所示的方法进行净水.