题目内容
【题目】某化学兴趣小组为了测定当地的石灰石(主要成分是CaCO3)的质量分数,他们做了如下实验:取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图所示,请根据图中的数据进行计算:
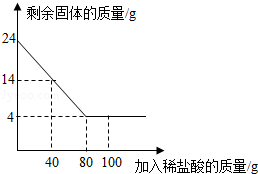
(1)石灰石样品中CaCO3的质量为 克.
(2)24克石灰石样品与盐酸充分反应后最多产生二氧化碳的质量为 克.
(3)求所用盐酸的溶质质量分数.(请根据化学方程式写出完整的计算步骤)
【答案】(1)20;(2)8.8;(3)所用盐酸的溶质质量分数为:18.25%
【解析】
试题分析:(1)由图象可知最终反应后固体的固体为4g,该质量即是剩余的不反应的杂质的质量,所以石灰石中碳酸钙的质量是24g﹣4g=20g;
(2)由图象可知碳酸钙与盐酸恰好反应时的用量是80g;
解:设参加反应的盐酸中HCl的质量为x.生成的二氧化碳的质量是y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
20g x y
![]()
x=14.6g y=8.8g
(3)由图象可知碳酸钙与盐酸恰好反应时的用量是80g;所以所用盐酸的质量分数为![]() ×100%=18.25%
×100%=18.25%

【题目】(4分)下表是元素周期表的一部分:
周期 | IA | 0 | ||||||
1 | 1 H 1.008 | 2 He 4.003 | ||||||
ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |||
2 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
3 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)14号元素的元素符号为 ;其相对原子质量为 ;
该元素的原子结构示意图为![]() ,X的数值= 。
,X的数值= 。
(2)表中不同种元素最本质的区别是 (填字母)。
A.质子数不同 B.相对原子质量不同
C.中子数不同 D.电子数不同