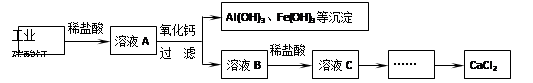题目内容
(2010.浙江杭州)31.某学校的课外活动小组要测定某块盐碱地中的NaCl、Na2SO4;、Na2CO3的含量,为盐碱地的改造提供依据。下面是他们的测定步骤:
(1)确定要测定地块的采样点。
(2)将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
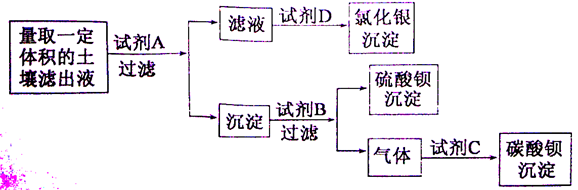
(3)对所取滤液进行以下实验:(实验过程中所加试剂均是足量的,得到的所有沉淀中的阴离子都来自原土壤滤出液中)
(4)称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。
请回答下列问题:
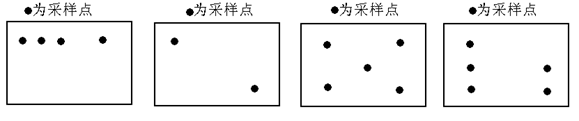
(1)设计采样点时有下列四种方案,选用方案__ __较为合理。
A B C D
(2)上述实验中试剂A的化学式是 ,试剂B的化学式是 ,气体和试剂C反应的化学方程式是__ 。
(3)若上述实验中试剂A为氯化钡溶液,则按上述实验步骤最终测得土壤中 的含量偏高。
(1)确定要测定地块的采样点。
(2)将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
(3)对所取滤液进行以下实验:(实验过程中所加试剂均是足量的,得到的所有沉淀中的阴离子都来自原土壤滤出液中)
(4)称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。

请回答下列问题:
(1)设计采样点时有下列四种方案,选用方案__ __较为合理。

A B C D
(2)上述实验中试剂A的化学式是 ,试剂B的化学式是 ,气体和试剂C反应的化学方程式是__ 。
(3)若上述实验中试剂A为氯化钡溶液,则按上述实验步骤最终测得土壤中 的含量偏高。
(1)C, (2) Ba(NO3)2 HNO3或HCl ;CO2 + Ba(OH)2 ="=" BaCO3↓+H2 O;
(3)NTaCl(或氯化钠)
(3)NTaCl(或氯化钠)
分析:(1)设计采样点,所取土样要在地块的不同地方分别取样,数据才更可靠;
(2)根据物质的性质分析解答;根据图示,首先加入硝酸钡将氯化钠分离出来;然后再根据碳酸钡可溶于酸,硫酸钡不溶于酸,通过测定硫酸钡的质量进而计算硫酸钠的质量;再通过生成碳酸钡的质量计算所含碳酸钠的质量;
(3)无论测定哪种盐的含量,都要排除干扰;若加入试剂A为氯化钡溶液,则会增加溶液中氯离子的量,使生成的氯化银质量增加,从而造成土壤中氯化钠的含量偏高.
解答:解:(1)设计采样点,所取土样要在地块的不同地方分别取样,数据才更可靠,观察图示,C方案符合条件;
(2)氯化钠可以加入硝酸银,通过测定氯化银的质量确定氯化钠的质量;硫酸钠可以加入钡盐,通过生成的硫酸钡确定硫酸钠的质量;根据图示,首先加入硝酸钡将氯化钠分离出来;然后再根据碳酸钡可溶于酸,硫酸钡不溶于酸,通过测定硫酸钡的质量进而计算硫酸钠的质量;再通过生成二氧化碳与氢氧化钡反应生成碳酸钡的质量计算所含碳酸钠的质量;
(3)无论测定哪种盐的含量,都要排除干扰;若加入试剂A为氯化钡溶液,则会增加溶液中氯离子的量,使生成的氯化银质量增加,从而造成土壤中氯化钠的含量偏高;
故答案为:
(1)C;
(2)Ba(NO3)2; HNO3或HCl;CO2+Ba(OH)2═BaCO3↓+H2O;
(3)NaCl(或氯化钠).
(2)根据物质的性质分析解答;根据图示,首先加入硝酸钡将氯化钠分离出来;然后再根据碳酸钡可溶于酸,硫酸钡不溶于酸,通过测定硫酸钡的质量进而计算硫酸钠的质量;再通过生成碳酸钡的质量计算所含碳酸钠的质量;
(3)无论测定哪种盐的含量,都要排除干扰;若加入试剂A为氯化钡溶液,则会增加溶液中氯离子的量,使生成的氯化银质量增加,从而造成土壤中氯化钠的含量偏高.
解答:解:(1)设计采样点,所取土样要在地块的不同地方分别取样,数据才更可靠,观察图示,C方案符合条件;
(2)氯化钠可以加入硝酸银,通过测定氯化银的质量确定氯化钠的质量;硫酸钠可以加入钡盐,通过生成的硫酸钡确定硫酸钠的质量;根据图示,首先加入硝酸钡将氯化钠分离出来;然后再根据碳酸钡可溶于酸,硫酸钡不溶于酸,通过测定硫酸钡的质量进而计算硫酸钠的质量;再通过生成二氧化碳与氢氧化钡反应生成碳酸钡的质量计算所含碳酸钠的质量;
(3)无论测定哪种盐的含量,都要排除干扰;若加入试剂A为氯化钡溶液,则会增加溶液中氯离子的量,使生成的氯化银质量增加,从而造成土壤中氯化钠的含量偏高;
故答案为:
(1)C;
(2)Ba(NO3)2; HNO3或HCl;CO2+Ba(OH)2═BaCO3↓+H2O;
(3)NaCl(或氯化钠).

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目