题目内容
(7分)做钠在氯所中燃烧的实验时,钠完全反应后,在集气瓶内放少量水来吸收过量的Cl2,但不能完全吸收。如何处理残余的Cl2呢?同学们进行了相关探究。
【提出问题】
向上述集气瓶中滴入石蕊溶液,发现溶液显红色。由此想到,选用氢氧化钠等碱性溶液吸收Cl2,效果会怎么样?
【查阅资料】
氯气是黄绿色有毒气体,溶于水,在饱和氯化钠溶液中的溶解度非常小。
【设计与实验】
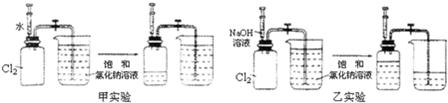
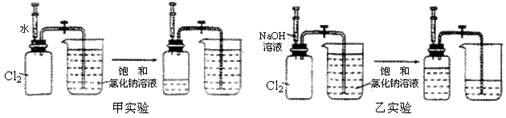
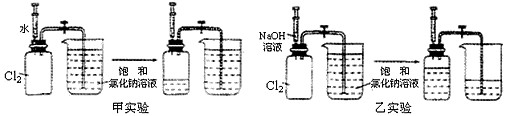
用两套完全相同的装置做对比实验,如下图所示:
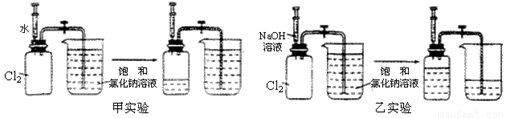
(1)为确保实验的准确性,要先检验装置的_____________________;
(2)实验开始时,先用弹簧夹夹紧乳胶管,再将注射器内等体积的水和NaOH溶液分别注入充满Cl2的集气瓶;
(3)充分吸收Cl2后,打开弹簧夹,观察进入两个集气瓶内饱和NaCl溶液的体积。
【结论与解释】
(1)甲实验中,Cl2溶于水且与水反应生成盐酸和次氯酸(HClO),反应的化学方程式为____________________________________。
(2)乙实验中,Cl2与NaOH易发生化学反应。
(3)分析实验现象得知,用碱性溶液比用水吸收Cl2的效果_________(填“好”或“差”)
【交流与反思】
(1)金属钠在氯气中燃烧的实验现象为__________________________________。
(2)向Cl2的水溶液中滴入硝酸银溶液有白色沉淀生成,化学方程式为:
_____________________________________________。
【答案】
(7分)【设计与实验】(1)气密性。【结论与解释】(1)Cl2+H2O=HCl+HClO;(3)好。【交流与反思】(1)剧烈燃烧,冒出大量白烟。(2)AgNO3+HCl=AgCl↓+HNO3
【解析】略

练习册系列答案
相关题目