题目内容
【题目】某校化学兴趣小组同学利用数字化仪器对镁与盐酸反应进行研究。
(查阅资料)
①饱和氯化镁溶液的pH约为4;②氢氧化镁加热到350℃失去水生成氧化镁。
(实验过程)
(1)实验前先将镁条需先打磨的原因是_____
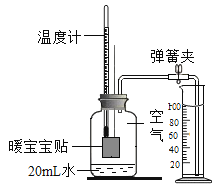
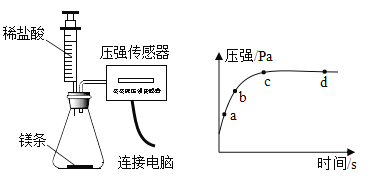
(2)将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图所示。
(3)用pH试纸测定反应后溶液的酸碱度。
(结果分析)
①将注射器刚注入盐酸时镁条表面无明显气泡,但此时压强上升迅速,原因可能是_____。
②镁条与盐酸反应的化学方程式为_____。图中a、b、c、d四个点中,产生氢气最快的为_____点。
③图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是_____。
④测定反应后的溶液pH的操作为_____(填对应选项的字母)。
A将pH试纸直接插入溶液中,并将试纸显示的颜色与标准比色卡比较,读出pH
B将pH试纸放在玻璃片上,用干净的玻璃棒蘸取溶液滴在pH试纸上,并将试纸显示的颜色与标准比色卡比较,读出pH
C将湿润的pH试纸放在玻璃片上,用干净的玻璃棒蘸取溶液滴在pH试纸上,并将试纸显示的颜色与标准比色卡比较,读出pH
⑤同学们根据测得反应后溶液的pH就直接得出其中含HCl,该pH的值可能是下列选项中的_____(填对应选项的字母)。
А 3В 5С 6
⑥甲同学提出向反应后的溶液中逐滴滴加NaOH溶液并振荡,若观察到_____的现象,也可以确定溶液中含HCl。
(拓展研究)
取少量镁条与过量盐酸反应后的溶液蒸干并灼烧,向灼烧所得固体中投入少量水,未见固体完全溶解,向其中滴加酚酞试液变为红色。灼烧所得固体的成分可能为_____。
【答案】除去镁条表面的氧化膜,便于后续反应进行 注入的盐酸占据一定体积,挤压装置内空气,使压强增大 Mg+2HCl=MgCl2+H2↑ a 反应停止不再产生气体、不再放热,容器内热量向外扩散,温度逐渐降低 B A 开始滴加的一段时间内无沉淀产生,滴加一段时间后才开始有白色沉淀产生 MgCl2、MgO
【解析】
[实验过程]
(1)为除去镁条表面的氧化膜,便于后续反应进行,实验前先将镁条打磨,故填:为除去镁条表面的氧化膜,便于后续反应进行。
[结果分析]
①反应刚开始,注入的盐酸占据一定体积,挤压装置内空气,使压强增大,故将注射器刚注入盐酸时镁条表面无明显气泡,但此时压强上升迅速,故填:注入的盐酸占据一定体积,挤压装置内空气,使压强增大。
②镁和盐酸反应生成氯化镁和氢气,化学方程式为Mg+2HCl=MgCl2+H2↑,a、b、c、d四个点中,a点压强变化最快,产生氢气最快的点是a点,故填:Mg+2HCl=MgCl2+H2↑;a。
③图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是反应停止不再产生气体、不再放热,容器内热量向外扩散,温度逐渐降低,故填:反应停止不再产生气体、不再放热,容器内热量向外扩散,温度逐渐降低。
④A、不能将pH试纸直接插入溶液中,会污染待测液,A错。
B、将pH试纸放在玻璃片上,用干净的玻璃棒蘸取溶液滴在pH试纸上,并将试纸显示的颜色与标准比色卡比较,读出pH,正确。
C、将湿润的pH试纸放在玻璃片上,用干净的玻璃棒蘸取溶液滴在pH试纸上,相当于待测液被稀释,会造成酸性溶液pH值偏大,碱性溶液pH偏小,C错。
故选:B。
⑤饱和氯化镁溶液的pH约为4,pH小于4 说明溶液中含有HCl,故选:A。
⑥向氯化镁和氯化氢混合溶液中滴加氢氧化钠,氢氧化钠先和氯化氢反应生成氯化钠和水,再和氯化镁生成氢氧化镁沉淀,和氯化钠,开始滴加的一段时间内无沉淀产生,滴加一段时间后才开始有白色沉淀产生,故填:开始滴加的一段时间内无沉淀产生,滴加一段时间后才开始有白色沉淀产生。
[拓展研究] 少量镁条与过量盐酸反应生成氯化镁以及剩余过量氯化氢,溶液蒸干氯化氢挥发会得到氯化镁固体,并且伴随着氯化氢挥发,氯化镁的缓慢水解,会得到氢氧化镁,氢氧化镁灼烧生成氧化镁,向灼烧所得固体中投入少量水,未见固体完全溶解是因为含有氧化镁,灼烧所得固体的成分可能MgCl2、MgO,故填:MgCl2、MgO。

 阅读快车系列答案
阅读快车系列答案