题目内容
19.铝合金的生产与销售是潍坊市一条重要的产业链.为测定某种铝铜合金中铝的质量分数,探究学习小组进行了如下实验:| 实验编号 | 铝铜合金的质量/g | 加入稀硫酸的质量/g | 生成H2的质量/g |
| 实验1 | 30 | 392 | 2 |
| 实验2 | 30 | 588 | 3 |
| 实验3 | 30 | 600 | 3 |
(2)所用稀硫酸溶质的质量分数为25%.
(3)该铝铜合金中铝的质量分数是多少?
分析 加入392g稀硫酸时,生成氢气的质量是2g,加入588g稀硫酸时,生成氢气的质量是3g,继续加入稀硫酸时不再产生氢气,说明588g稀硫酸和铝恰好反应生成3g氢气,根据氢气的质量可以计算硫酸和铝的质量,进一步可以计算所用稀硫酸溶质的质量分数和该铝铜合金中铝的质量分数.
解答 解:(1)加入392g稀硫酸时,生成氢气的质量是2g,加入588g稀硫酸时,生成氢气的质量是3g,继续加入稀硫酸时不再产生氢气,说明588g稀硫酸和铝恰好反应,故硫酸溶液完全反应的是2次实验;故填:2;
(2)设铝的质量为x,588g稀硫酸中硫酸的质量为y,
2Al+3H2SO4═Al2(SO4)3+3H2↑,
54 294 6
x y 3g
$\frac{54}{x}=\frac{294}{y}=\frac{6}{3g}$,
x=27g,y=147g,
所用稀硫酸溶质的质量分数为:$\frac{147g}{588g}$×100%=25%,
故填:25%.
(2)该铝铜合金中铝的质量分数为:$\frac{27g}{30g}$×100%=90%,
答:该铝铜合金中铝的质量分数为90%.
点评 铜不能和稀硫酸反应,铝和稀硫酸反应生成硫酸铝和氢气,因此过程中产生的氢气都是由铝和稀硫酸反应生成的.

练习册系列答案
相关题目
9.合理使用化肥是农作物增产的有效措施之一.下列物质中可用作复合肥的是( )
| A. | K2SO4 | B. | NH4NO3 | C. | NH4 H2PO4 | D. | Ca(H2P04)2 |
10.下列有关说法中
①同种分子构成的一定是化合物
②化合物肯定是由不同种元素组成的物质
③铁与盐酸反应放出氢气,反应后溶液的质量减轻.
④铁与氧气反应后生产氧化铁,反应后固体增重,但符合质量守恒定律
⑤实验室可利用一氧化碳置换出氧化铁中的铁.
你认为以上叙述中正确的个数是( )
①同种分子构成的一定是化合物
②化合物肯定是由不同种元素组成的物质
③铁与盐酸反应放出氢气,反应后溶液的质量减轻.
④铁与氧气反应后生产氧化铁,反应后固体增重,但符合质量守恒定律
⑤实验室可利用一氧化碳置换出氧化铁中的铁.
你认为以上叙述中正确的个数是( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
11.下列实验现象的描述正确的是( )
| A. | 向装有大理石的试管中加入适量稀盐酸产生二氧化碳 | |
| B. | 铁丝在空气中剧烈燃烧、火星四射,生成黑色固体物质 | |
| C. | 硫在氧气中燃烧发出明亮蓝紫色火焰 | |
| D. | 雪碧摇一摇再打开瓶盖,会看到二氧化碳气体喷出 |
8.同学们在学习了木炭还原氧化铜的实验后,联想到单质碳的一些化学性质,对反应后的气体成分产生了疑问,某学习小组对该反应产物中的气体成分进行了探究.
〔猜 想〕
①气体产物全部是CO2 ②气体产物全部是CO ③气体产物气体产物是CO和CO2的混合物
〔查阅资料〕CO气体能使湿润的黄色氯化钯试纸变蓝色.
〔设计实验〕根据各自的猜想,他们共同设计了如图的实验装置进行探究.

〔现象与分析〕
〔结论〕实验现象证明猜想③成立,同学们的疑问是合理的.
〔反思〕
(1)同学们对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
②原因二:反应中的一种产物和反应物木炭又发生了化学反应,产生了CO;
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO或CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO.
(2)根据上述实验,请你归纳出单质碳在工业上的重要用途单质碳在工业上的重要用是途冶炼金属
(3)从环保角度考虑,该套实验装置的明显缺陷是没有尾气处理.
〔猜 想〕
①气体产物全部是CO2 ②气体产物全部是CO ③气体产物气体产物是CO和CO2的混合物
〔查阅资料〕CO气体能使湿润的黄色氯化钯试纸变蓝色.
〔设计实验〕根据各自的猜想,他们共同设计了如图的实验装置进行探究.

〔现象与分析〕
| 现象 | 结论 |
| 如果装置B如果装置B澄清石灰水变浑浊,装置C无现象,装置C无现象 | 则猜想①成立 |
| 如果如果装置B无现象,装置C试纸由黄色变为蓝色 | 则猜想②成立 |
| 如果如果装置B澄清石灰水变浑浊,装置C试纸由黄色变为蓝色 | 则猜想③成立 |
〔反思〕
(1)同学们对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
②原因二:反应中的一种产物和反应物木炭又发生了化学反应,产生了CO;
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO或CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO.
(2)根据上述实验,请你归纳出单质碳在工业上的重要用途单质碳在工业上的重要用是途冶炼金属
(3)从环保角度考虑,该套实验装置的明显缺陷是没有尾气处理.
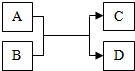 A、B、C、D都是初中化学中常见物质,它们间关系如图所示(反应条件已省略).(1)若A为一氧化碳,C为金属,则D为CO2;
A、B、C、D都是初中化学中常见物质,它们间关系如图所示(反应条件已省略).(1)若A为一氧化碳,C为金属,则D为CO2;