题目内容
(2007?南宁)某化学兴趣小组从某地采集到一块石灰石样品,想测定其主要成分CaCO3的质量分数,将其敲碎,取12.5g样品放入试管中,然后加入一定量的10%的稀盐酸(杂质不与盐酸反应也不溶于水),恰好完全反应,收集到4.4g的气体.求:(1)样品中CaCO3的质量分数;
(2)加入的稀盐酸的质量;
(3)反应后所得溶液的质量.
【答案】分析:本题可直接利用4.4g的气体即二氧化碳的质量,借助化学方程式来进行相关的计算.根据质量守恒来计算反应后溶液的质量.
解答:解:设样品中含碳酸钙的质量为x,盐酸溶液中含HCl的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
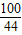 =
=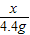 x=
x=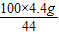 =10g
=10g
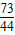 =
=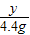 y=
y=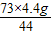 =7.3g
=7.3g
则(1)样品中CaCO3的质量分数为 %═80%;
%═80%;
(2)加入的稀盐酸的质量为:7.3g÷10%=73g;
(3)反应后所得溶液的质量为:10g+73g-4.4g=78.6g.
答:(1)样品中CaCO3的质量分数为80%;(2)加入的稀盐酸的质量为73g;(3)反应后所得溶液的质量为78.6g.
点评:本题较简单,可直接利用化学方程式来计算,但应注意计算格式要规范,向规范要质量.
解答:解:设样品中含碳酸钙的质量为x,盐酸溶液中含HCl的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
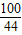 =
=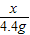 x=
x=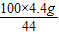 =10g
=10g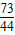 =
=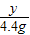 y=
y=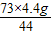 =7.3g
=7.3g则(1)样品中CaCO3的质量分数为
 %═80%;
%═80%;(2)加入的稀盐酸的质量为:7.3g÷10%=73g;
(3)反应后所得溶液的质量为:10g+73g-4.4g=78.6g.
答:(1)样品中CaCO3的质量分数为80%;(2)加入的稀盐酸的质量为73g;(3)反应后所得溶液的质量为78.6g.
点评:本题较简单,可直接利用化学方程式来计算,但应注意计算格式要规范,向规范要质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
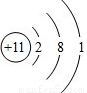 .下列说法错误的是( )
.下列说法错误的是( )