题目内容
将40 g 10%的氢氧化钠溶液与100 g 3.65%的盐酸混合,所得溶液中溶质的质量分数约为
A.
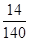 ×100% B.
×100% B. 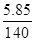 ×100%
×100%
C.
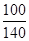 ×100% D.
×100% D.  ×100%
×100%
B
【解析】考点定位分析:本题的考点是根据化学反应方程式的计算,有关溶质质量分数的简单计算,中和反应。根据化学反应方程式的计算的步骤一般分为六步:
1.设未知量,即---的质量为x;
2.书写用到的化学方程式(即写→配→标→注),特别是化学方程式的配平是至关重要的;
3.将用到的物质的质量关系标注在相应的化学式的正下方;上行是相对质量关系(即利用相对原子质量或相对分子质量乘以相应的化学计量数得来的),下行是纯物质质量(即已知量和未知量x);
4.列计算用到比例式,即上行的相对质量比等于下行的实际质量比;
5.求算结果,注意一定要有单位;
6.写出简明的答案,一般是问什么就答什么。
解答过程分析:根据氢氧化钠与盐酸反应的化学方程式中两物质的质量关系,可判断将40g 10%的氢氧化钠溶液与100g 3.65%的盐酸混合时,两物质恰好完全反应,反应后得到氯化钠溶液,由化学方程式求得生成氯化钠的质量、由质量守恒求得反应所得溶液的质量,即可列出所得溶液中溶质的质量分数的算式。
解:40g10%的氢氧化钠溶液中含氢氧化钠质量40g×10%=4g,100g 3.65%的盐酸中含HCl的质量=100g×3.65%=3.65g,
设反应生成氯化钠的质量为x
NaOH+HCl═NaCl+H2O
40 36.5 58.5
4g 3.65g x
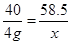 解得x=5.85g
解得x=5.85g
所得溶液中溶质的质量分数=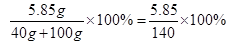 故选B
故选B
试题总结评价:根据反应的化学方程式中物质的质量比,判断反应物是否完全反应,是解答此类反应物质量均已知类问题的前提。

 阅读快车系列答案
阅读快车系列答案