题目内容
已知某无色溶液中,可能含有H+、Ag+、K+、Cu2+、Cl-、OH-、NO3-、CO32-等八种离子中的几种,取该溶液少许,滴入几滴石蕊试液,石蕊试液变红,则原溶液中大量存在的离子可能是.
【答案】分析:酸性溶液能使紫色的石蕊试液呈红色;
在溶液中,要想离子共存,离子相互之间不能发生反应,即不能有气体或水或沉淀产生.
解答:解:氢离子和氢氧根离子不能共存,因为会生成水;铜离子和氢氧根离子不能共存,因为会生成氢氧化铜的蓝色沉淀;银离子、铜离子都不能与碳酸根离子共存,因为会生成沉淀.有因为该溶液少许,滴入几滴石蕊试液,石蕊试液变红,所以一定存在氢离子.
故答案为:两种离子时H+、NO3-或H+、Cl-.
三种离子时H+、Ag+、NO3-或H+、K+、NO3-或H+、K+、Cl-或H+、Cl-、NO3-.
四种离子时H+、Ag+、K+、NO3-或H+、K+、Cl-、NO3-
点评:在溶液中,要想离子共存,离子相互之间不能发生反应,即不能有气体或水或沉淀产生.
在溶液中,要想离子共存,离子相互之间不能发生反应,即不能有气体或水或沉淀产生.
解答:解:氢离子和氢氧根离子不能共存,因为会生成水;铜离子和氢氧根离子不能共存,因为会生成氢氧化铜的蓝色沉淀;银离子、铜离子都不能与碳酸根离子共存,因为会生成沉淀.有因为该溶液少许,滴入几滴石蕊试液,石蕊试液变红,所以一定存在氢离子.
故答案为:两种离子时H+、NO3-或H+、Cl-.
三种离子时H+、Ag+、NO3-或H+、K+、NO3-或H+、K+、Cl-或H+、Cl-、NO3-.
四种离子时H+、Ag+、K+、NO3-或H+、K+、Cl-、NO3-
点评:在溶液中,要想离子共存,离子相互之间不能发生反应,即不能有气体或水或沉淀产生.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
| 某研究性学习兴趣小组同学在学习了酸、碱、盐的知识后,走进化学实验室。邀请你参与以下活动。(已知①2Na2CO3+ H2SO4===NaHCO3+Na2SO4 ,NaHCO3溶液呈碱性;②CaSO4微溶,但在稀溶液中看作可溶,其水溶液呈中性) (1)甲、乙两同学想用实验证明稀硫酸和NaOH稀溶液确实能发生反应,设计了如图A所示的实验。丙、丁两同学想再现课本上将“澄清的石灰水滴入Na2CO3溶液”的现象,设计了如图B所示的实验,并各自进行操作。 | ||||
 | ||||
| 【问题讨论】教师首先肯定了这四位同学的实验设计和操作,请你填空:甲、乙同学将较多量的稀硫酸加入锥形瓶后,他们是依据溶液的颜色由 色变为 色的现象来判断两者确实发生反应的。丙、丁同学的实验中发生的复分解反应可用化学方程式表示为 【意外发现】甲同学和丙同学在洗刷仪器前,将A、B装置锥形瓶中的残留物倒入同一个洁净的废液缸,发现白色沉淀溶解,有气泡产生,废液缸中形成无色溶液,这一现象立刻引起了同学们的好奇。于是,他们又以“无色溶液中含有那些溶质”为课题进行研究。 【提出猜想】经讨论呈现出如下猜想: ①溶质为:Na2SO4 CaSO4 ②溶质为:Na2SO4 CaSO4 H2SO4 ③溶质为:Na2SO4 CaSO4 NaOH 请你判断:上述猜想中不合理的是 (填数字代号) 【实验探究】小组同学针对认为合理的猜想,设计实验进行探究,请你将下表补充完整。 | ||||
①Na2SO4 NaOH;②Na2SO4 Ca(OH)2;③Na2SO4 NaOH Na2CO3; ④Na2SO4 ⑤Na2SO4 Na2CO3 (未列全。请用化学式将④⑤补充完整) (2)教师点拨:证明稀硫酸和NaOH稀溶液确实能发生反应的方法还有多种。 【拓展探究】小组同学用其他装置继续进行实验。请你回答下列问题 ①若不加酚酞试液,将稀硫酸(适量)与NaOH稀溶液混合后,再向其中加入CuSO4溶液至蓝色沉淀生成,则 (填“能”或“不能”)证明两者确实发生了反应。 ②若不加酚酞试液,将稀硫酸(少量)与V1mLNaOH稀溶液混合后,再向其中CuSO4溶液至蓝色沉淀不再产生时,消耗了V2mLCuSO4溶液,此时还必须做一个对比实验才能证明两者确实发生了反应,这个对比实验是 (简述操作方法及结论)证明稀硫酸和NaOH稀溶液确实发生了反应。 |
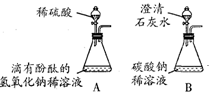
 (2012?姜堰市二模)某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:CaSO4微溶,但在稀溶液中看作可溶,其水溶液呈中性.)
(2012?姜堰市二模)某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:CaSO4微溶,但在稀溶液中看作可溶,其水溶液呈中性.)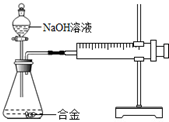 合金在生活中应用十分广泛.已知某合金粉末除含金属铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含金属铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.