题目内容
【题目】某工业废液中含有CuSO4、ZnSO4、FeSO4,如果将废液直接排放就会造成水污染。于是几位同学设计实验处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:请回答:
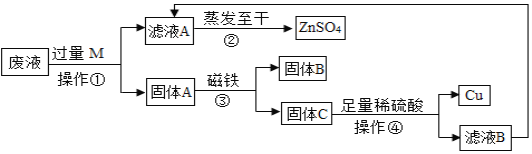
(1)操作①的名称是______________,需要的玻璃仪器有烧杯、________ 、玻璃棒。
(2)固体A中一定有___________。判断操作④中稀硫酸足量的方法是_________ 。
(3) 滤液A、滤液B合起来蒸发至干目的是________________ 。
【答案】过滤 漏斗(或普通漏斗或三角漏斗) Zn、Fe、Cu 再加稀硫酸,无气泡生成 提高产率
【解析】
(1)操作①是固体和液体分离,在实验室中该操作为过滤;需要的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)废液中含有硫酸铜、硫酸锌和硫酸亚铁,加入的过量锌粉与硫酸铜和硫酸亚铁反应生成硫酸锌,所以固体A中含有Zn、Cu、Fe,检验加入的稀硫酸是否足量:取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生,则酸已足量),即由题意可推知铁与稀硫酸反应;
(3)滤液A、滤液B合起来蒸发至干目的是提高产率。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目